Estudo internacional com participação de 7 centros de pesquisa brasileiros foi um dos destaques do ESMO 2025, avaliando apalutamida (ERLEADA®) mais terapia de privação androgênica (ADT) contínua versus intermitente no câncer de próstata metastático hormônio sensível (mHSPC). Os resultados mostram que 71% dos participantes alcançaram PSA indetectável em 6 meses com apalutamida (APA) + ADT, a taxa mais alta já relatada em estudos semelhantes. “É uma pesquisa extremamente importante no cenário do câncer de próstata metastático hormônio sensível”, analisa o oncologista Fernando Maluf (foto), que comenta os principais achados.
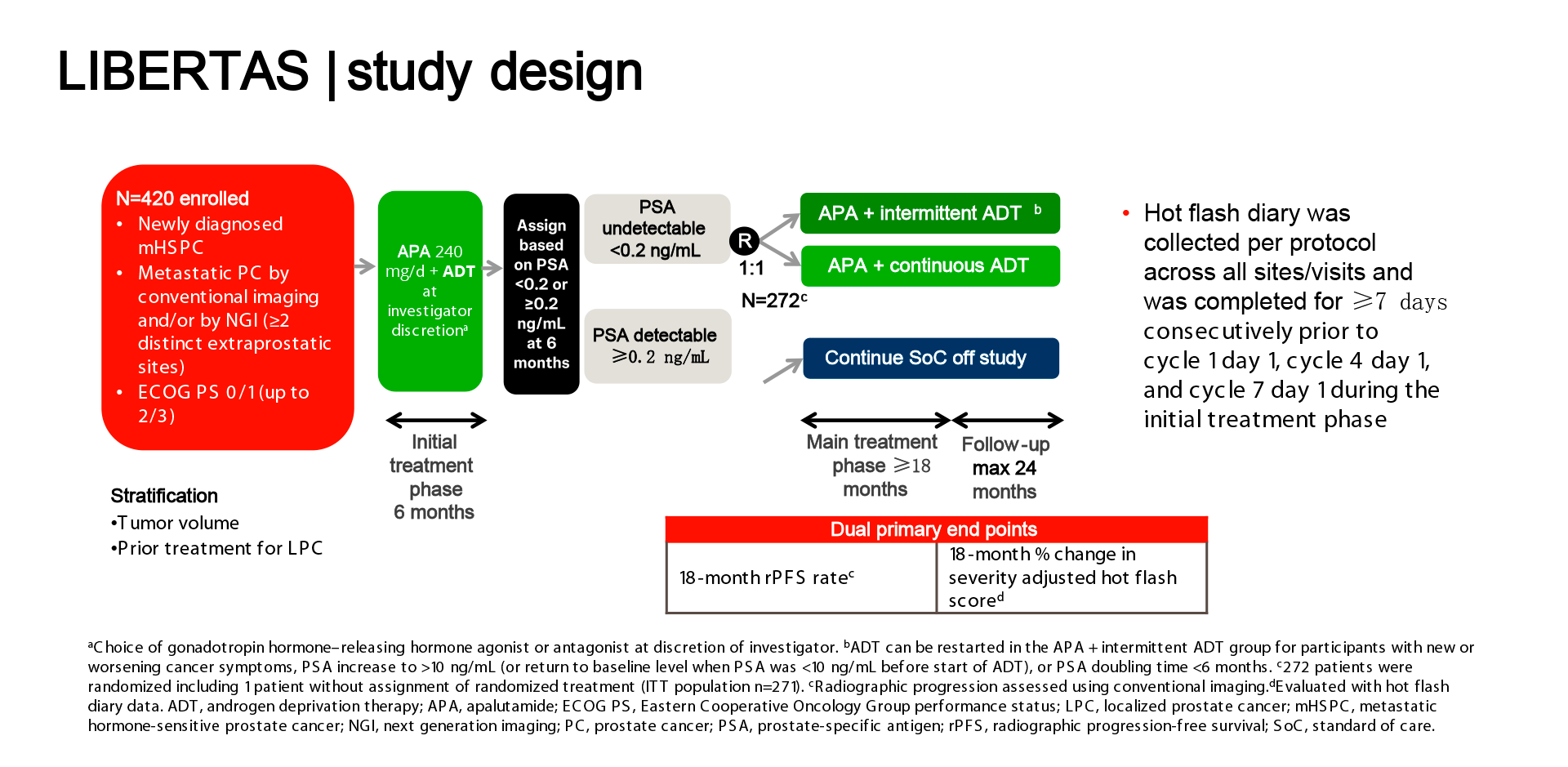
Este estudo prospectivo (LIBERTAS) é o primeiro de fase 3 a explorar o uso de APA em combinação com ADT intermitente como estratégia de redução da ADT em pacientes com mHSPC que atingiram PSA < 0,2 ng/mL após 6 meses de tratamento inicial com APA + ADT (Figura 1).
Fonte: Prevalence and Severity of Hot Flashes and Their Association With Prostate-specific Antigen Response: Results From the Initial Treatment Phase of LIBERTAS, A Phase 3 Study in Metastatic Hormone-Sensitive Prostate Cancer - Presented by: Alicia K. Morgans, MD, MPH, Genitourinary Medical Oncologist, Medical Director of Survivorship Program at Dana-Farber Cancer Institute, Boston, MAduring the 2025 European Society of Medical Oncology (ESMO) Annual Meeting, Berlin, Germany, Fri, Oct 17 – Tues, Oct 21, 2025.
LIBERTAS (Clinical trial information: NCT05884398) utiliza critérios de elegibilidade que permitem a inclusão de indivíduos anteriormente sub-representados em ensaios clínicos, como participantes negros e afro-americanos, participantes transgêneros, não binários, com deficiência, bem como aqueles com metástases identificadas apenas por tomografia por emissão de pósitrons (PET) com PSMA. Os participantes do grupo GAC (Gender-affirming care) foram considerados elegíveis para inclusão com ou sem evidência de metástase por imagem convencional ou NGI (next-generation Imaging).
Dados atualizados mostram que 420 pacientes foram incluídos para a fase inicial do tratamento de 6 meses, envolvendo 73 centros de pesquisa, em 9 países (conjunto de análise completa). Todos os participantes receberam APA 240 mg/d + ADT. Na fase principal de tratamento, os participantes com PSA confirmado <0,2 ng/mL após a fase inicial foram randomizados 1:1 para APA 240 mg/d + ADT intermitente ou contínua. Os desfechos primários incluíram sobrevida livre de progressão radiológica (SLPr) e redução da carga de ondas de calor (fogachos), medida por pontuação específica (ondas de calor ajustada pela gravidade).
Os resultados apresentados no ESMO 20252 mostram que a mediana do PSA basal (BL) foi de 7,3 ng/mL. Dos 383 pacientes que concluíram o tratamento inicial, 271 (71%) atingiram PSA < 0,2 ng/mL e foram randomizados, constituindo a população por intenção de tratar (ITT). A adesão ao diário de ondas de calor (coletado por protocolo em todos os locais/visitas) foi > 93%/> 95% dentro do tratamento inicial para o conjunto de dados de análise completa/ITT.
“Nessa desintensificação de tratamento proposta pelo regime intermitente, o objetivo é promover a mesma eficácia de APA +ADT, às custas de menor toxicidade”, explica Fernando Maluf, Oncologista do Hospital Israelita Albert Einstein e da BP, a Beneficência Portuguesa de São Paulo. “Nos pacientes incluídos nos 6 meses antes da randomização para APA + ADT, 70% atingiram resposta de PSA rápida e profunda, mostrando a atividade desse regime. Além disso, em um prazo de 6 meses, 70,6% dos participantes dessa primeira fase antes da randomização entre APA com ADT contínua versus APA com ADT intermitente atingiram PSA < 0,2 ng/mL e 79% tiveram queda de PSA ≥ 90% em relação ao baseline, sem novos sinais de segurança”, destacou, acrescentando que 95,8% dos participantes tiveram resposta do PSA ≥ 50%.
Outro dado atualizado no congresso europeu revela que a taxa de fogachos aumentou em > 23% nos 6 meses iniciais em relação ao baseline, em ambos os conjuntos de dados; a mediana da pontuação média diária ajustada para a gravidade das ondas de calor também aumentou (veja tabela abaixo). A segurança foi consistente com a experiência anterior.
Full analysis N=420 | With hot flash at BL N=248 | Without hot flash at BL N=172 | |
Hot flash | |||
Hot flash incidence, n/n (%) At BL At 6 months |
248/404 (61) 295/344 (86 |
248/248 (100) 184/206 (89) |
0 / 156 (0) 111/138 (80) |
Median (IQR) severity-adjusted hotflash score* At BL At 6 months |
0.6 (0-3.7) 5.2 (1.3-11.4) |
2.5 (0.8-7.6) 6.2 (2.0-12.5) |
NA 3.7 (0.9-10.0) |
Deterioration in hot flash during Increase of ≥2 average hot flashes ≥50% increase in severity – |
194/314 (62)
NA |
117/199 (59)
135/199 (68) |
77/115 (67)
NA |
Fonte: Prevalence and Severity of Hot Flashes and Their Association With Prostate-specific Antigen Response: Results From the Initial Treatment Phase of LIBERTAS, A Phase 3 Study in Metastatic Hormone-Sensitive Prostate Cancer - Presented by: Alicia K. Morgans, MD, MPH, Genitourinary Medical Oncologist, Medical Director of Survivorship Program at Dana-Farber Cancer Institute, Boston, MAduring the 2025 European Society of Medical Oncology (ESMO) Annual Meeting, Berlin, Germany, Fri, Oct 17 – Tues, Oct 21, 2025.
O estudo amplia os resultados apresentados no ASCO GU 2025. A análise anterior incluiu 143 pacientes com mHSPC que completaram a fase inicial de 6 meses com APA + ADT, dos quais 98 (68,5%) atingiram um declínio profundo de PSA (< 0,2 ng/mL). O estudo então randomizou esses pacientes para comparar a desintensificação da terapia com a manutenção do tratamento padrão.
Em síntese, durante o tratamento com APA + ADT na fase inicial do estudo LIBERTAS, antes da randomização, 71% dos participantes que concluíram a fase inicial de tratamento de 6 meses com apalutamida (APA) + terapia de privação androgênica (ADT) apresentaram declínio de PSA < 0,2 ng/mL; a carga de ondas de calor foi alta e aumentou do BL aos 6 meses, mas foi independente da resposta do PSA.
Em conclusão, o tratamento com 6 meses de APA + ADT neste estudo prospectivo resultou em respostas profundas de PSA na maioria dos pacientes com câncer de próstata metastático sensível à castração. O estudo LIBERTAS continua no caminho certo para a conclusão bem-sucedida da randomização esperada para a redução padrão de APA + ADT.
VÍDEO
LIBERTAS confirma resposta de PSA com APA + ADT intermitente no câncer de próstata metastático
Fernando Maluf, Oncologista do Hospital Israelita Albert Einstein e da BP, a Beneficência Portuguesa de São Paulo, fala sobre o acompanhamento do estudo LIBERTAS, apresentado no ESMO 2025. “Nessa desintensificação de tratamento proposta pelo regime intermitente, o objetivo é promover a mesma eficácia de APA +ADT, às custas de menor toxicidade”, explica Maluf. “Nos pacientes incluídos nos 6 meses antes da randomização para APA + ADT, 70% atingiram resposta de PSA rápida e profunda, mostrando a atividade desse regime. Além disso, em um prazo de 6 meses, 70,6% dos participantes dessa primeira fase antes da randomização entre APA com ADT contínua versus APA com ADT intermitente atingiram PSA < 0,2 ng/mL e 79% tiveram queda de PSA ≥ 90% em relação ao baseline, sem novos sinais de segurança”, destacou, acrescentando que 95,8% dos participantes tiveram resposta do PSA ≥ 50%. Assista.
Referências:
- Azad, A., et al - Deep Prostate-specific Antigen Decline Among Early Participants in LIBERTAS, a Phase 3 Study of Apalutamide Plus Continuous Versus Intermittent Androgen Deprivation Therapy in Metastatic Castration-Sensitive Prostate Cancer. - Presented during the 2025 Genitourinary (GU) American Society of Clinical Oncology (ASCO) Annual Meeting, San Francisco, CA, Thurs, Feb 13 – Sat, Feb 15, 2025.
- Prevalence and Severity of Hot Flashes and Their Association With Prostate-specific Antigen Response: Results From the Initial Treatment Phase of LIBERTAS, A Phase 3 Study in Metastatic Hormone-Sensitive Prostate Cancer - Presented by: Alicia K. Morgans, MD, MPH, Genitourinary Medical Oncologist, Medical Director of Survivorship Program at Dana-Farber Cancer Institute, Boston, MAduring the 2025 European Society of Medical Oncology (ESMO) Annual Meeting, Berlin, Germany, Fri, Oct 17 – Tues, Oct 21, 2025.