A Agência Nacional de Vigilância Sanitária (ANVISA) ampliou a indicação terapêutica de durvalumabe (IMFINZI®, AstraZeneca) no câncer de pulmão de células não pequenas (CPCNP). A decisão foi publicada no Diário Oficial da União1 (DOU) de 1º de setembro1 com base nas evidências de eficácia e segurança do estudo AEGEAN, que demonstrou benefício de durvalumabe nos desfechos de pacientes com CPCNP no contexto do tratamento com intenção curativa.
O câncer de pulmão é a principal causa de morte por câncer entre homens e mulheres, responsável por cerca de um quinto de todas as mortes por câncer5. A cirurgia se mantém como espinha dorsal do tratamento de intenção curativa para pacientes com CPCNP com doença estadio I-IIIA, como recomendam as diretrizes do NCCN6. No entanto, existem claras necessidades não atendidas mesmo após a ressecção curativa, uma vez que micro metástases podem levar à recorrência da doença7. As taxas de sobrevida global em 5 anos são de 53% para pacientes com estadio IIB e caem para apenas 26% na doença avançada (estádio IIIB)8, 9, 10.
É nesse contexto que os regimes perioperatórios baseados na imunoterapia (IO) têm a intenção de atuar contra as células tumorais antes e depois da cirurgia11, 12.
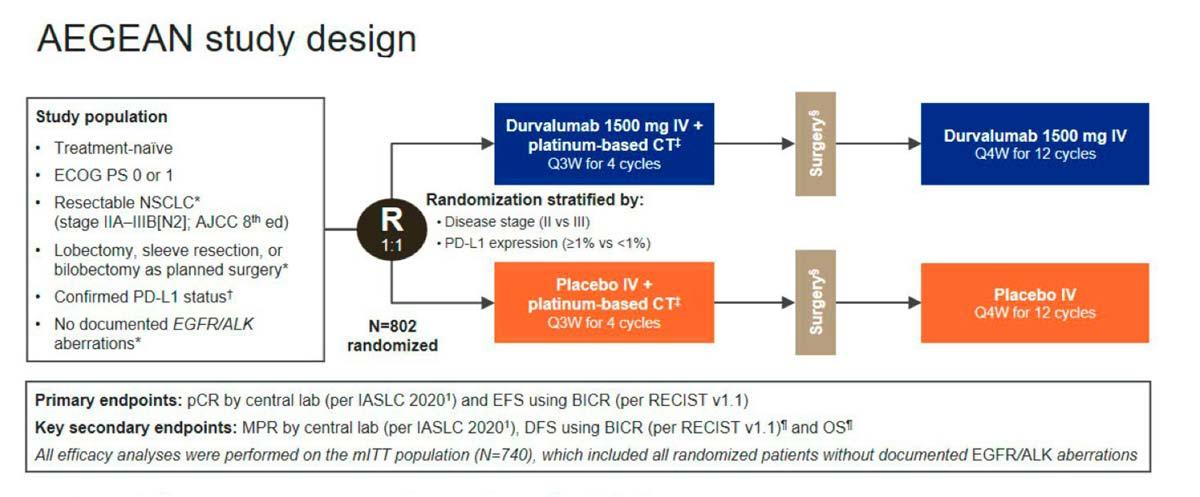
AEGEAN foi um estudo multicêntrico de Fase III, randomizado, duplo-cego, controlado por placebo, desenhado para avaliar a eficácia de durvalumabe em combinação com quimioterapia à base de platina como tratamento neoadjuvante, seguido da continuação de durvalumabe em monoterapia após a cirurgia, em pacientes com CPCNP ressecável, com tumores ≥ 4 cm e/ou nódulo positivo, sem mutações conhecidas no receptor do fator de crescimento epidérmico (EGFR) ou rearranjos da quinase do linfoma anaplásico (ALK)2, 3.
No estudo pivotal AEGEAN (NCT03800134) foram incluídos pacientes com CPCNP escamoso ou não escamoso sem tratamento prévio, com status performance da OMS/ECOG de 0 ou 1 e pelo menos uma lesão-alvo avaliada por RECIST 1.1.2,3
Um total de 802 pacientes foram randomizados em uma proporção de 1:1 para receber durvalumabe perioperatório (Braço 1) ou placebo (Braço 2) em combinação com quimioterapia neoadjuvante. Não foi permitido cruzamento entre os braços do estudo. Pacientes elegíveis receberam quimioterapia à base de platina mais durvalumabe ou placebo, administrados por via intravenosa a cada 3 semanas durante 4 ciclos antes da cirurgia, seguidos por durvalumabe adjuvante ou placebo por via intravenosa a cada 4 semanas durante 12 ciclos13. A randomização foi estratificada de acordo com o estágio da doença (II ou III) e a expressão do ligante de morte programada 1 (PD-L1) (≥1% ou <1%). Os desfechos primários foram resposta patológica completa (pCR), avaliada por revisão central cega de patologia, e sobrevida livre de eventos (SLE), definida como o tempo até a ocorrência mais precoce de doença progressiva que impediu a cirurgia ou a conclusão da cirurgia, recorrência da doença ou morte por qualquer causa (avaliada de forma cega por revisão central independente). A sobrevida global (SG) foi um desfecho secundário chave2,4.
Fonte: Heymach JV. et al.; AEGEAN Investigators. Perioperative Durvalumab for Resectable Non-Small- Cell Lung Cancer. N Engl J Med. 2023 Nov 2;389(18):1672-1684.
As análises de eficácia foram realizadas na população com intenção de tratar modificada, enquanto a segurança foi avaliada em todos os pacientes que foram submetidos à randomização e receberam pelo menos uma dose de qualquer tratamento do estudo3.
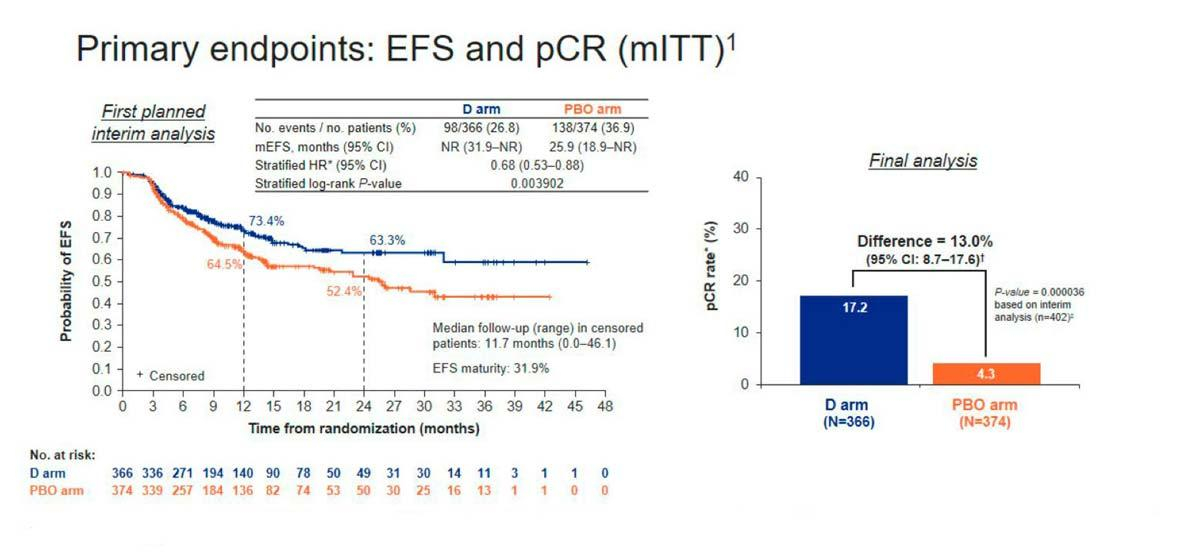
Na análise primária pré-especificada (data de corte de dados: 10 de novembro de 2022), com maturidade de 31,9% e seguimento mediano de 11,7 meses, a duração da sobrevida livre de eventos foi significativamente maior com durvalumabe do que com placebo; a razão de risco (HR) para progressão da doença, recorrência ou morte foi de 0,68, indicando que durvalumabe reduziu em 32% o risco de SLE (intervalo de confiança [IC] de 95%, 0,53 a 0,88; p=0.003902)3. Na análise de referência de 12 meses, a SLE foi observada em 73,4% dos pacientes que receberam durvalumabe (IC de 95%, 67,9 a 78,1), em comparação com 64,5% daqueles que receberam placebo (IC de 95%, 58,8 a 69,6)2.
O tratamento perioperatório com durvalumabe também aumentou a resposta patológica completa, que foi significativamente maior com durvalumabe do que com placebo (17,2% vs. 4,3%; diferença de 13,0%; IC de 95%, 8,7 a 17,6; P < 0,001). O benefício de SLE e da pCR foram observados independentemente do estágio da doença e da expressão de PD-L1.2,3
Fonte: Heymach JV et al. NEJM 2023, DOI: 10.1056/NEJMoa2304875; e Heymach JV. et al.; AEGEAN Investigators. Perioperative Durvalumab for Resectable Non-Small- Cell Lung Cancer. N Engl J Med. 2023 Nov 2;389(18):1672-1684.
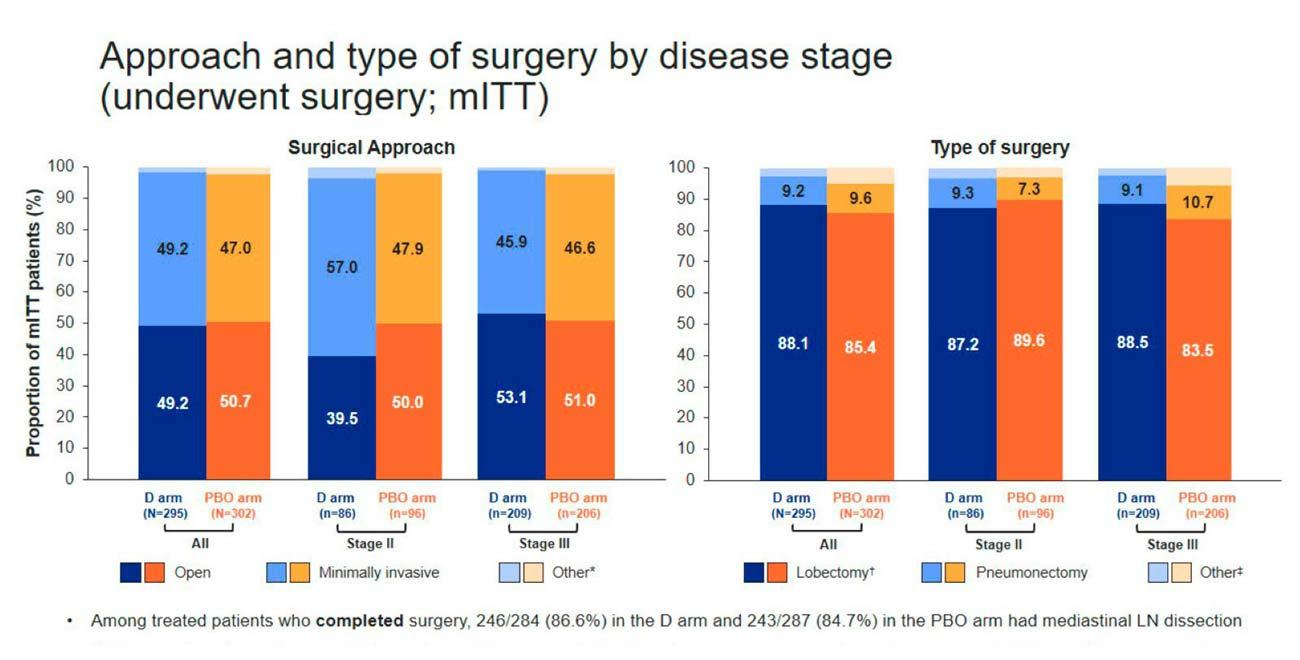
Os resultados também mostram que o tempo até a cirurgia e a viabilidade cirúrgica foram comparáveis entre o grupo que recebeu durvalumabe neoadjuvante e o grupo placebo. Mais pacientes em estágio III foram submetidos ou concluíram a cirurgia no braço tratado com durvalumabe (269/284 [94,7%]) em comparação ao braço neoadjuvante placebo associado à quimioterapia baseada em platina (262/287 [91,3%])2.
“Mais de 90% dos pacientes que receberam durvalumabe neoadjuvante alcançaram ressecção R0, independentemente do estadio da doença. Mesmo naqueles com maior volume de doença, a ressecção R0 foi numericamente maior”, destaca Pedro Henrique Nabuco de Araújo, cirurgião torácico do Instituto do Câncer do Estado de São Paulo.
Fonte: Heymach JV et al. NEJM 2023, DOI: 10.1056/NEJMoa2304875; e Heymach JV, el al. Cancer Res 2023; 83 (8_Supplement):CT005
Dados da segunda análise interina apresentados na World Conference on Lung Cancer 2024 (WCLC 2024)4 com cerca de 25 meses de seguimento confirmaram a magnitude do benefício de durvalumabe perioperatório no CPCNP, demonstrando redução no risco de progressão da doença de 31% para o desfecho de sobrevida livre de eventos (HR 0,69; IC de 95%, 0,55–0,88).
Embora os dados de sobrevida global ainda não estejam maduros, os resultados apresentados na WCLC 2024 com base na maturidade de 35% indicaram tendência de sobrevida global, favorecendo o braço durvalumabe4.
“Outro indicador importante do estudo AEGEAN é a sobrevida câncer de pulmão específica. É um dado muito interessante, que ainda não está maduro, mas as curvas já começam a se separar com mais nitidez”, diz Maikol Kurahashi, oncologista clínico e diretor técnico no Eco Oncologia. “Fico muito confortável hoje em oferecer esse esquema perioperatório para o paciente, diante da consistência dos dados”, analisa.
Em relação à segurança, eventos adversos de grau máximo 3 ou 4 ocorreram em 42,4% dos pacientes com durvalumabe e em 43,2% dos participantes que receberam placebo. As reações adversas mais comuns (≥ 20%) foram anemia, náusea, constipação, fadiga, dor musculoesquelética e erupção cutânea2, 4.
Em síntese, em pacientes com CPCNP ressecável, durvalumabe mais quimioterapia contendo platina como tratamento neoadjuvante seguido por durvalumabe de agente único como tratamento adjuvante após a cirurgia prolongou a sobrevida livre de eventos e aumentou a incidência de resposta patológica completa em adultos com câncer de pulmão de células não pequenas ressecável (tumores ≥ 4 cm e/ou linfonodos positivos) e nenhuma mutação conhecida de EGFR ou rearranjos ALK, com perfil de segurança consistente com o perfil de segurança individual dos agentes2, 4.
Durvalumabe (IMFINZI®, AstraZeneca)14 é um anticorpo monoclonal IgG1 humano seletivo e de alta afinidade que se liga à proteína PD-L1 e bloqueia sua interação com as proteínas PD-1 e CD80, combatendo as táticas de evasão imunológica dos tumores e liberando as respostas imunológicas.
Em vídeo:
Durvalumabe perioperatório no câncer de pulmão ressecável
Pedro Henrique Nabuco de Araújo, cirurgião torácico do Instituto do Câncer do Estado de São Paulo, e Maikol Kurahashi, oncologista clínico e diretor técnico no Eco Oncologia, discutem em vídeo o regime AEGEAN, estudo multicêntrico de Fase III, desenhado para avaliar a eficácia de durvalumabe em combinação com quimioterapia à base de platina como tratamento neoadjuvante, seguido da continuação de durvalumabe em monoterapia após a cirurgia, em pacientes com CPCNP ressecável, com tumores ≥ 4 cm e/ou nódulo positivo, sem mutações conhecidas no receptor do fator de crescimento epidérmico (EGFR) ou rearranjos da quinase do linfoma anaplásico (ALK)2, 3. Assista.
- Diário Oficial da União, Edição 165, Seção: 1, Página 153, publicado em 01/09/2025;
- Heymach JV et al. NEJM 2023, DOI: 10.1056/NEJMoa2304875;
- Heymach JV. et al. ; AEGEAN Investigators. Perioperative Durvalumab for Resectable Non-Small- Cell Lung Cancer. N Engl J Med. 2023 Nov 2;389(18):1672-1684.
- Heymach JV et al. Abstract OA13.03. apresentado na WCLC 2024;
- https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/estimativa-2023.pdf
- National Comprehensive Cancer Network® (NCCN®). NCCN Clinical Practice Guidelines in Oncology: Non-Small Cell Lung Cancer. Version 8.2025, August 15, 2025. Available at: nccn.org.
- Uramoto H, et al. Recurrence after surgery in patients with NSCLC. Trans Lung Cancer Res.2014;3(4):242–249
- Goldstraw P, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016;11(1):39–51;
- Sugimura H, et al. Survival after recurrent nonsmall-cell lung cancer after complete pulmonary resection. Ann Thorac Surg. 2007;83(2):409–417.
- Demicheli R, et al. Recurrence dynamics for non-small-cell lung cancer: effect of surgery on the development of metastases. J Thorac Oncol. 2012;7(4):723–730;
- Krishnamoorthy M, et al. Neoadjuvant Immunotherapy for High-Risk, Resectable Malignancies: Scientific Rationale and Clinical Challenges. J Natl Cancer Inst. 2021;113(7):823–832;
- Tang W-F, et al. Adjuvant immunotherapy in early-stage resectable nonsmall cell lung cancer: A new milestone. FrontOncol. 2023;13:1063183.
- Heymach JV. et al.; AEGEAN Investigators. Perioperative Durvalumab for Resectable Non-Small-Cell Lung Cancer. N Engl J Med. 2023 Nov 2;389(18):1672-1684.
- https://www.astrazeneca.com.br/content/dam/az-br/Medicine/medicine-pdf/Imfinzi_Bula_Pacientes.pdf