Os pesquisadores Mary E. Brunkow, Fred Ramsdell e Shimon Sakaguchi foram contemplados com o Prêmio Nobel de Fisiologia ou Medicina de 2025 por suas descobertas inovadoras sobre a tolerância imunológica periférica, que impede o sistema imunológico de causar danos ao corpo. Em mais um tópico da coluna ‘Drops de Genômica’, o oncologista Andre Murad (foto) explica o impacto dessas descobertas no tratamento do câncer.
Por André Marcio Murad*
A ativação e a tolerância das células T são rigorosamente reguladas para garantir a eliminação eficaz de antígenos estranhos, mantendo a tolerância imunológica aos próprios antígenos. Historicamente, os mecanismos subjacentes à indução e à manutenção da tolerância têm sido o foco principal de pesquisadores que buscam prevenir doenças autoimunes. No entanto, objetivos opostos são revelados no campo da imunologia tumoral, onde vários mecanismos de evasão imunológica tumoral, como a indução de células T tolerantes, Tregs e células supressoras derivadas de mieloides (MDSCs), permitem o crescimento de tumores.
O mecanismo primário de autotolerância é a deleção central, na qual as células T autorreativas são eliminadas no timo por seleção negativa. Embora a maioria das células autorreativas seja deletada por esse mecanismo, ele é incompleto e mecanismos de tolerância adicionais são necessários. O sistema imunológico desenvolveu mecanismos de tolerância periférica para lidar com as células T autorreativas na periferia. A tolerância periférica é regulada por diferentes mecanismos, que podem ser divididos entre aqueles que regulam o estado de resposta das células T intrinsecamente (anergia, apoptose e distorção fenotípica) e aqueles que fornecem controle extrínseco (Tregs e células dendríticas tolerogênicas [DCs]).
Em última análise, a compreensão dos mecanismos moleculares subjacentes à tolerância das células T no microambiente tumoral nos faculta o desenvolvimento de abordagens farmacológicas para quebrar a tolerância aos antígenos tumorais e induzir respostas antiproliferativas e pró-apoptóticas.
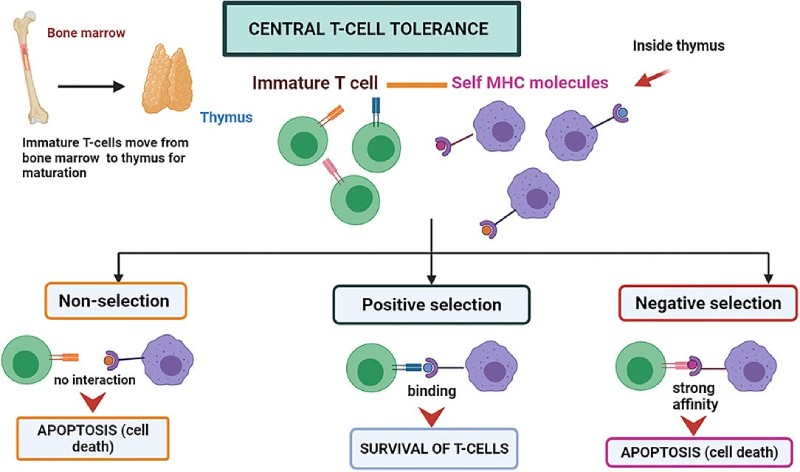
Um sobrevoo no Mecanismo Central de Tolerância às Células T
- As células T amadurecem no timo, onde são testadas quanto à sua capacidade de interagir com moléculas de MHC (complexo principal de histocompatibilidade) próprias. Esse processo de triagem garante que apenas células T funcionais e não autorreativas possam amadurecer e entrar na circulação.
- Seleção Positiva: se uma célula T em desenvolvimento se liga moderadamente às moléculas de MHC próprias, ela recebe sinais de sobrevivência e continua a amadurecer. Isso é chamado de seleção positiva e garante que a célula T possa reconhecer o MHC próprio, essencial para a função imunológica.
- Seleção Negativa: se a célula T se ligar muito fortemente ao MHC próprio (especialmente quando complexado com o antígeno próprio), ela pode se tornar autorreativa. Essas células T sofrem seleção negativa, ou morte celular programada (apoptose), para prevenir a autoimunidade.
- Não Seleção (morte por negligência): se a célula T não reconhecer ou se ligar a nenhuma molécula de MHC própria, ela não receberá os sinais de sobrevivência necessários. Isso leva à não seleção, também chamada de morte por negligência, em que a célula T morre devido à falta de estimulação.
Juntas, seleção positiva, seleção negativa e não seleção formam o núcleo da tolerância central, ajudando a moldar um repertório de células T funcional e autotolerante.
*André Murad é diretor científico do Grupo Brasileiro de Oncologia de Precisão (GBOP), diretor clínico da Personal - Oncologia de Precisão e Personalizada, professor adjunto coordenador da Disciplina de Oncologia da Faculdade de Medicina da UFMG, e oncologista e oncogeneticista da Clínica OncoLavras





