Em mais um tópico da coluna ‘Drops de Genômica’, o oncologista Andre Murad (foto) aborda os modelos de ativação de receptores associados à tirosina quinase. “Esses receptores desempenham papéis vitais na sinalização imunológica, mas carecem de atividade catalítica intrínseca”, explica. Confira.
Por André Marcio Murad*
Para iniciar a sinalização, esses receptores requerem a fosforilação de suas caudas citoplasmáticas, particularmente em motivos especializados baseados em tirosina, como ITAM, ITIM e sequências semelhantes a ITAM.
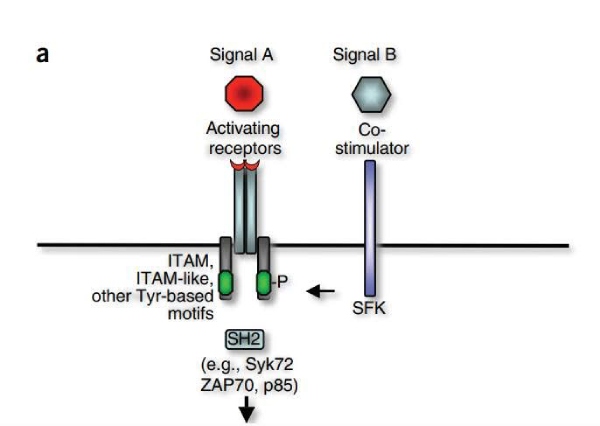
Modelo Clássico: Quinases da Família Src (SFKs)
No modelo clássico, a iniciação do sinal depende das quinases da família Src (SFKs), que atuam como as principais enzimas de iniciação da tirosina. Essas quinases são recrutadas para o complexo receptor por meio de interações com correceptores que ajudam a localizar as SFKs no domínio citoplasmático do receptor. Após o recrutamento, as SFKs fosforilam motivos de tirosina nos receptores, desencadeando vias de sinalização a jusante.
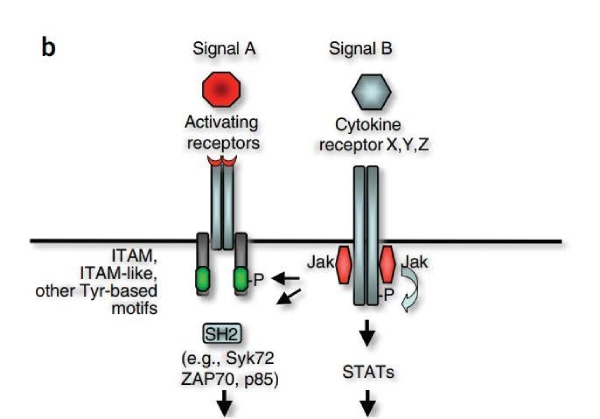
Papel Emergente das Kinases Jak
Descobertas recentes sugerem um papel alternativo ou complementar para as kinases Janus (Jaks) na fosforilação de receptores contendo motivos de tirosina. Isso adiciona uma nova camada de complexidade, visto que as kinases Jak, tipicamente associadas à sinalização de receptores de citocinas, também podem contribuir para o priming de receptores imunológicos em certos contextos.
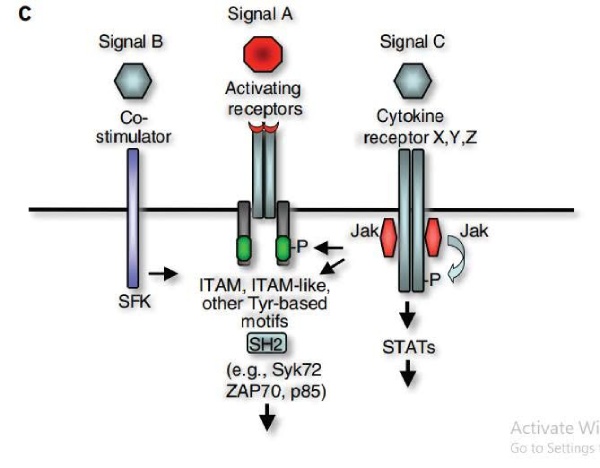
Modelo Multirreceptor Integrado
Um modelo mais avançado propõe um acoplamento transitório entre receptores contendo motivos de tirosina e correceptores ou receptores de citocinas. Nesse sistema integrado, a sinergia dos receptores gera sinais específicos para cada tipo de célula. Nesse caso, os receptores de citocinas detectam a variabilidade ambiental e retransmitem essa informação fosforilando resíduos de tirosina associados a receptores de antígenos ou outros alvos a jusante.
Essa cooperação multirreceptora, envolvendo cinases Src, cinases Jak e vários correceptores, cria um sistema flexível e evolutivo. Permite que as células imunes se adaptem rapidamente a diversos sinais fisiológicos, garantindo um controle preciso sobre a ativação e regulação imunológica.
*André Murad é diretor científico do Grupo Brasileiro de Oncologia de Precisão (GBOP), diretor clínico da Personal - Oncologia de Precisão e Personalizada, professor adjunto coordenador da Disciplina de Oncologia da Faculdade de Medicina da UFMG, e oncologista e oncogeneticista da Clínica OncoLavras





