O oncologista Andre Murad (foto) explica as adaptações biológicas das células malignas à hipóxia. Entre essas adaptações estão danos ao DNA e reparo prejudicado, superregulação de HIF-1α por vias de sinalização, perda de supressores tumorais e contribuição para ROS, papel do pVHL na regulação do HIF-1α, e ativação de genes responsivos à hipóxia. Confira, em mais um tópico da coluna ‘Drops de Genômica’.
Por André Marcio Murad*
- Danos ao DNA e Reparo Prejudicado
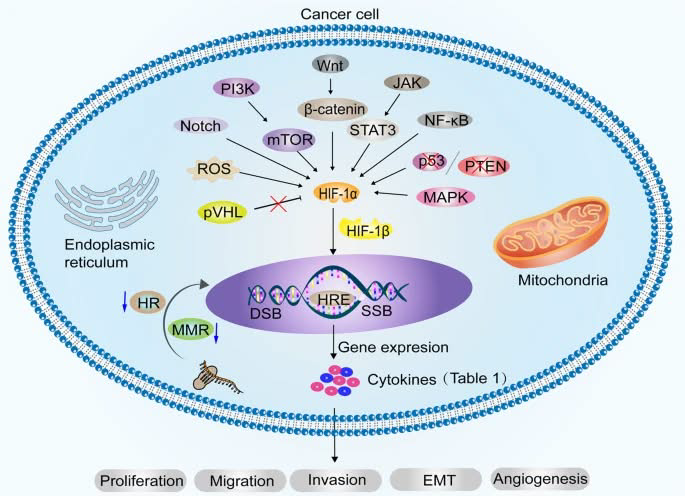
A hipóxia contribui para a carcinogênese ao induzir quebras na fita de DNA, incluindo quebras de fita simples (SSBs) e quebras de fita dupla (DSBs). Ao mesmo tempo, enfraquece vias essenciais de reparo do DNA, como recombinação homóloga (HR) e reparo de mismatch (MMR), tornando as células cancerosas mais instáveis geneticamente.
- Superregulação de HIF-1α por Vias de Sinalização
Em condições hipóxicas, diversas vias de sinalização oncogênicas — incluindo PI3K-mTOR, JAK-STAT3, NF-κB, MAPK, Wnt/β-catenina e Notch — ativam e estabilizam o fator 1-alfa induzível por hipóxia (HIF-1α), um regulador-chave da resposta celular à baixa oxigenação.
- Perda de Supressores Tumorais e Contribuição para ROS
A deleção ou inativação de genes supressores tumorais, como p53 e PTEN, juntamente com o aumento da produção de espécies reativas de oxigênio (ROS), contribui ainda mais para o acúmulo de HIF-1α. Essas alterações criam um ambiente celular que favorece a progressão do câncer.
- Papel do pVHL na Regulação do HIF-1α
Em condições normais de oxigênio, a proteína pVHL auxilia na degradação do HIF-1α. No entanto, em ambientes hipóxicos ou em casos em que o pVHL sofre mutação ou é perdido, essa degradação é prejudicada, levando ao acúmulo de HIF-1α na célula.
- Ativação de Genes Responsivos à Hipóxia
Uma vez estabilizado, o HIF-1α dimeriza-se com o HIF-1β e transloca-se para o núcleo. Lá, liga-se aos elementos de resposta à hipóxia (HREs) no DNA e ativa a transcrição de uma série de genes-alvo. Esses genes controlam processos como proliferação, migração, invasão, transição epitelial-mesenquimal (TEM) e angiogênese de células cancerígenas, todos os quais promovem a agressividade tumoral.
*André Murad é diretor científico do Grupo Brasileiro de Oncologia de Precisão (GBOP), diretor clínico da Personal - Oncologia de Precisão e Personalizada, professor adjunto coordenador da Disciplina de Oncologia da Faculdade de Medicina da UFMG, e oncologista e oncogeneticista da Clínica OncoLavras





