Até bem pouco tempo atrás, os chamados soft tissue sarcomas (STS) ou sarcomas de partes moles, tinham limitadas opções na doença avançada ou metastática. A chegada da trabectedina (YONDELIS®, Adium) reconfigura esse cenário de tratamento, demonstrando controle superior da doença, na comparação com dacarbazina, em pacientes com avanço metastático, após falha à quimioterapia. A Adium acaba de anunciar seu lançamento no Brasil.
Depois dos tumores estromais gastrointestinais, os leiomiossarcomas e os lipossarcomas são os subtipos mais comuns de sarcomas de partes moles, um grupo heterogêneo de mais de 100 subtipos histológicos que surgem de tecidos de origem mesenquimal e, juntos, compõem aproximadamente 1% de todos os tumores sólidos. De acordo com a American Cancer Society, em 2025 serão diagnosticados 13.520 novos casos de sarcomas de partes moles nos EUA (7.600 em homens e 5.920 em mulheres), com cerca de 5.420 mortes1. No Brasil, o trabalho de Munhoz e col., publicado em 2020 em Annals of Oncology, mostra que a incidência de todos os sarcomas variou de 4.912 a 8.090 novos casos/ano, com tendência ascendente ao longo do tempo, resultando em taxas de incidência de 2,50 a 3,84 novos casos/100.000 habitantes/ano2.
No contexto de um câncer raro e com limitadas opções de tratamento, trabectedina mostrou benefício clínico e estatisticamente significativo em estudo multicêntrico internacional - o primeiro ensaio clínico de fase III a comparar trabectedina versus dacarbazina em pacientes com doença avançada, após terapia prévia com antraciclina e pelo menos um regime sistêmico adicional. Os resultados de Demetri et al (JCO 34, 786-793; 2016) mostram que, em uma população de alto risco e politratada, a administração de trabectedina resultou em redução estatisticamente significativa de 45% no risco de progressão da doença ou morte na comparação com dacarbazina (P < 0,001)3.
"A aprovação desse medicamento ajuda a preencher uma lacuna no tratamento de sarcomas avançados de tecidos moles, uma área com poucas opções terapêuticas eficazes. É um marco importante, que vai impactar positivamente a vida de muitos pacientes", avalia a oncologista Bruna David, pesquisadora clínica do Instituto Nacional do Câncer (INCA) e líder nacional do Grupo Oncoclinicas para a área de sarcomas.
Do Programa clínico – estudo de fase III
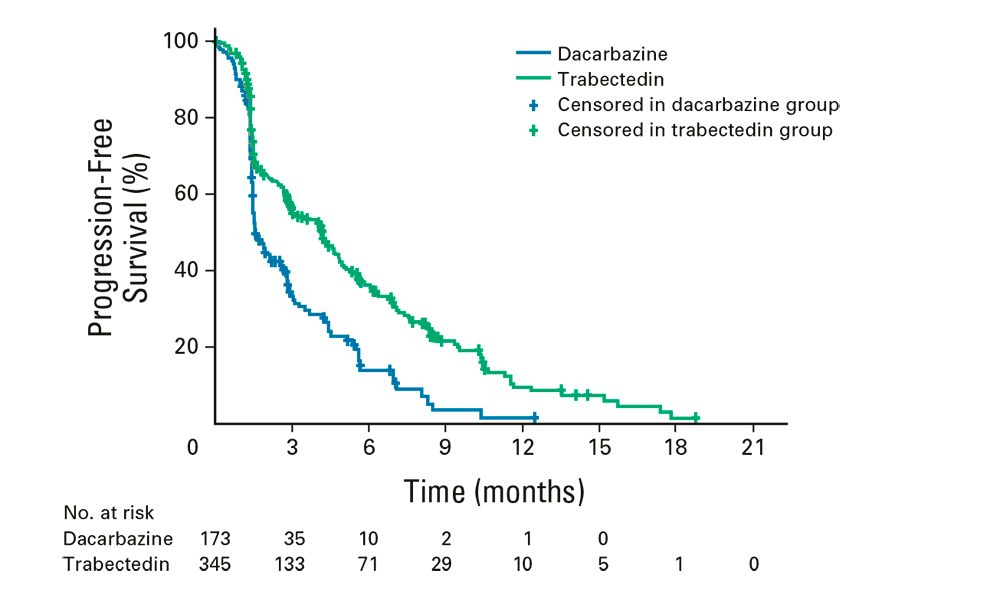
Neste ensaio clínico de fase III (NCT01343277), que contou com a participação de 85 centros, em quatro países, os pacientes elegíveis foram randomizados na proporção de 2:1 para receber trabectedina ou dacarbazina por via intravenosa, a cada 3 semanas. O desfecho primário foi a sobrevida global (SG); os desfechos secundários foram o controle da doença, a sobrevida livre de progressão (SLP), o tempo até a progressão, a taxa de resposta objetiva e a duração de resposta, bem como a taxa de benefício clínico, os dados de segurança, incluindo a pontuação dos sintomas relatada pelos pacientes3.
Um total de 518 pacientes foram incluídos e randomizados para trabectedina (n = 345) ou dacarbazina (n = 173). Os participantes representavam uma população de pacientes fortemente pré-tratada: 88% haviam recebido pelo menos duas linhas prévias de quimioterapia, mais de 90% tinham cirurgia anterior e 50% tinham sido tratados com radioterapia3.
A análise final de SLP (realizada após 329 eventos de SLP) mostra que a administração de trabectedina reduziu em 45% o risco de progressão da doença ou morte na comparação com dacarbazina, com SLP mediana de 4,2 versus 1,5 meses (razão de risco, 0,55; IC 95%, 0,44 a 0,70; P < 0,001)3.
As taxas de SLP em 3 e 6 meses foram de 56% e 37%, respectivamente, no braço de trabectedina versus 34% e 14%, respectivamente, no braço de dacarbazina. O benefício foi observado em todas as análises de subgrupos pré-planejadas, independentemente da histologia da doença, linhas anteriores de terapia sistêmica ou características clínicas, como idade, sexo, etnia ou estado geral de saúde3.
O benefício do tratamento com trabectedina vs. dacarbazina foi apoiado por outros desfechos secundários, com melhorias tanto na taxa de resposta objetiva (9,9% vs. 6,9%, respectivamente), quanto na duração mediana das respostas (6,5 vs. 4,2 meses, respectivamente). A atividade anticâncer da trabectedina fica amplamente evidenciada pela taxa de benefício clínico (34% vs. 19%), quase o dobro da proporção de pacientes que receberam trabectedina versus aqueles que receberam dacarbazina, refletindo tanto o controle da doença (em, no mínimo, 18 semanas), quanto a taxa de resposta objetiva3.
A análise interina de SG (maturidade de 64%) também apontou a eficácia de trabectedina, demonstrando redução de 13% no risco de morte (razão de risco, 0,87; P < 0,37)3.
Os perfis de segurança foram consistentes com as toxicidades já conhecidas dos dois agentes. Os eventos adversos (EA) de grau 3 a 4 mais comuns foram mielossupressão e elevação transitória das transaminases no braço de trabectedina. A vasta experiência clínica com a trabectedina na prática internacional, reforça a sua reputação como agente geralmente bem tolerado, o que foi novamente demonstrado neste estudo de Demetri et al., com baixas taxas de mucosite e alopecia e sem toxicidades cumulativas que limitem a duração do tratamento3.
“A trabectedina demonstra controle superior da doença em comparação com dacarbazina em pacientes com sarcomas avançados de partes moles após falha da quimioterapia anterior. Como o controle da doença em sarcomas avançados é um desfecho clinicamente relevante, este estudo apoia a atividade da trabectedina nessa população de pacientes”, destacam os autores.
- American Cancer Society, Key Statistics for Soft Tissue Sarcomas (available at https://www.cancer.org/cancer/types/soft-tissue-sarcoma/about/key-statistics.html)
- 1641P Bone and soft tissue sarcoma in Brazil: Estimating the epidemiological landscape via a computerized data-capture tool; Ramella Munhoz, R. et al.; Annals of Oncology, Volume 31, S982 - S983
- George D. Demetri et al.; Efficacy and Safety of Trabectedin or Dacarbazine for Metastatic Liposarcoma or Leiomyosarcoma After Failure of Conventional Chemotherapy: Results of a Phase III Randomized Multicenter Clinical Trial. JCO 34, 786-793(2016). DOI:1200/JCO.2015.62.4734