A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou a indicação de osimertinibe (Tagrisso®, AstraZeneca) para pacientes com câncer de pulmão de células não pequenas (CPCNP) com mutação de EGFR e doença estágio III irressecável, em resposta à importante necessidade médica não atendida1. A decisão da Anvisa é baseada nos resultados do estudo de fase 3 LAURA, que demonstrou benefício clínico e estatisticamente significativo de osimertinibe nessa população de pacientes, com mediana de sobrevida livre de progressão de 39 meses em comparação a 6 meses no grupo placebo, reduzindo em 84% o risco de progressão da doença ou morte (HR= 0.16). Após 12 meses, 74% dos pacientes tratados com osimertinibe estavam livres de progressão da doença, contra 22% no grupo controle.
Destaque da sessão Plenária no ASCO 20242, com publicação simultânea do artigo científico no New England Journal of Medicine (NEJM)3, o estudo LAURA embasou a aprovação das principais autoridades regulatórias mundiais e constituiu a base de evidências para a atualização das diretrizes de tratamento da Sociedade Americana de Oncologia Clínica (ASCO). A atualização foi publicada no Journal of Clinical Oncology (JCO)4 e recomenda o uso de osimertinibe como terapia de consolidação após quimiorradioterapia definitiva em pacientes com CPCNP estágio III irressecável com deleção do éxon 19 do EGFR ou mutação L858R do éxon 21.
No Brasil, estudo que analisou retrospectivamente mutações no EGFR em uma grande coorte de pacientes com CPCNP em cenário do mundo real mostrou que, de 7.413 amostras testadas, a taxa média de detecção positiva de mutações no EGFR foi de 24,2%5. O trabalho tem como primeira autora a oncologista Tatiane Montella, do Instituto Oncoclínicas (RJ), e é a maior análise do status mutacional do EGFR em pacientes brasileiros com CPCNP.
Eficácia e Segurança
No estudo LAURA, um ensaio global de fase 3, duplo-cego, controlado por placebo (NCT03521154), o objetivo foi avaliar a eficácia e a segurança de osimertinibe no CPCNP EGFR mutado (EGFRm) em pacientes com doença estágio III, irressecável, sem progressão após quimiorradioterapia (QRT) definitiva baseada em platina.
Foram recrutados pacientes adultos (≥18 anos); (≥20 no Japão), com bom status de performance (PS 0/1 da OMS), com CPCNP EGFRm com doença estágio III (Ex19del/L858R) irressecável, que receberam QRT concomitante/sequencial definitiva baseada em platina, sem progressão.
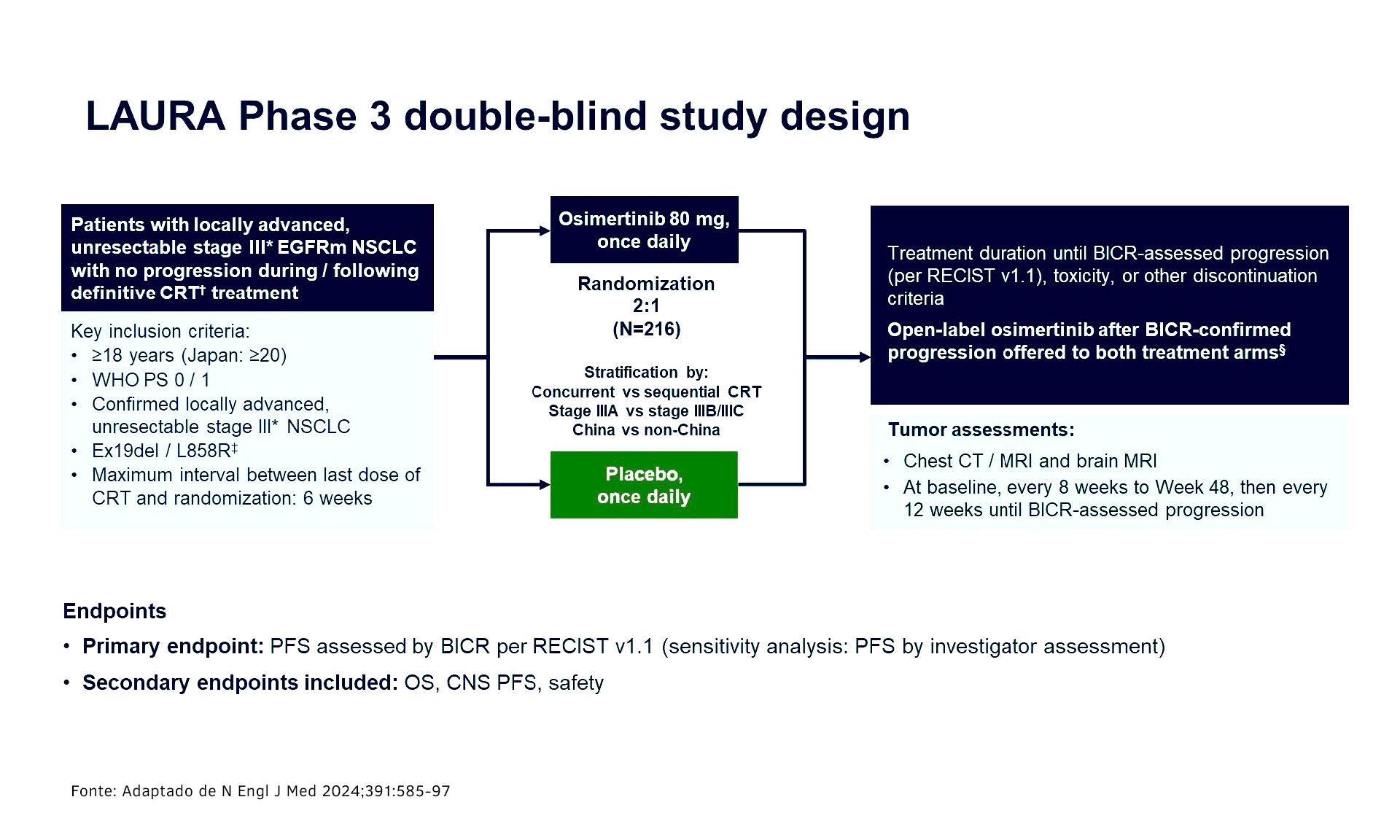
Os pacientes elegíveis foram estratificados (estágio IIIA vs IIIB/IIIC; chinês vs não chinês) e randomizados 2:1 para receber osimertinibe 80 mg ou placebo (PBO), até a progressão de doença ou toxicidade inaceitável. Imagens, incluindo ressonância magnética cerebral, foram obrigatórias no início do estudo, a cada 8 semanas até a semana 48, depois a cada 12 semanas até a progressão avaliada por comitê central independente cego (BICR). O desfecho primário foi a sobrevida livre de progressão (RECIST v1.1) avaliada por BICR. Os desfechos secundários incluíram sobrevida global (SG) e segurança. O corte de dados foi em 5 de janeiro de 2024.
Os resultados revelam que 216 pacientes foram randomizados para osimertinibe n=143 ou PBO n=73. A mediana de idade dos participantes foi de 62 anos no braço osimertinibe e de 64 anos no braço placebo. As características basais foram equilibradas entre os braços osimertinibe/PBO: mulheres 63/58%, estágios IIIA 36/33%, IIIB 47/52%, IIIC 17/15%, Ex19del 52/59%.
O tratamento com osimertinibe trouxe incremento significativo em SLP na avaliação por BICR (HR 0,16; IC de 95% 0,10, 0,24; p<0,001), reduzindo em 84% o risco de progressão da doença ou morte. A SLP mediana foi de 39,1 meses (IC de 95% 31,5, não calculável) para osimertinibe vs 5,6 meses (IC de 95% 3,7, 7,4) para PBO. A taxa de SLP em 12 meses foi de 74% (osimertinibe) vs 22% (PBO); a taxa de SLP em 24 meses foi de 65% (osimertinibe) vs 13% (PBO). A SLP avaliada pelo investigador (HR 0,19; IC de 95% 0,12, 0,29; p nominal < 0,001) foi consistente com a SLP avaliada por BICR. O benefício de SLP foi consistente em todos os subgrupos predefinidos.
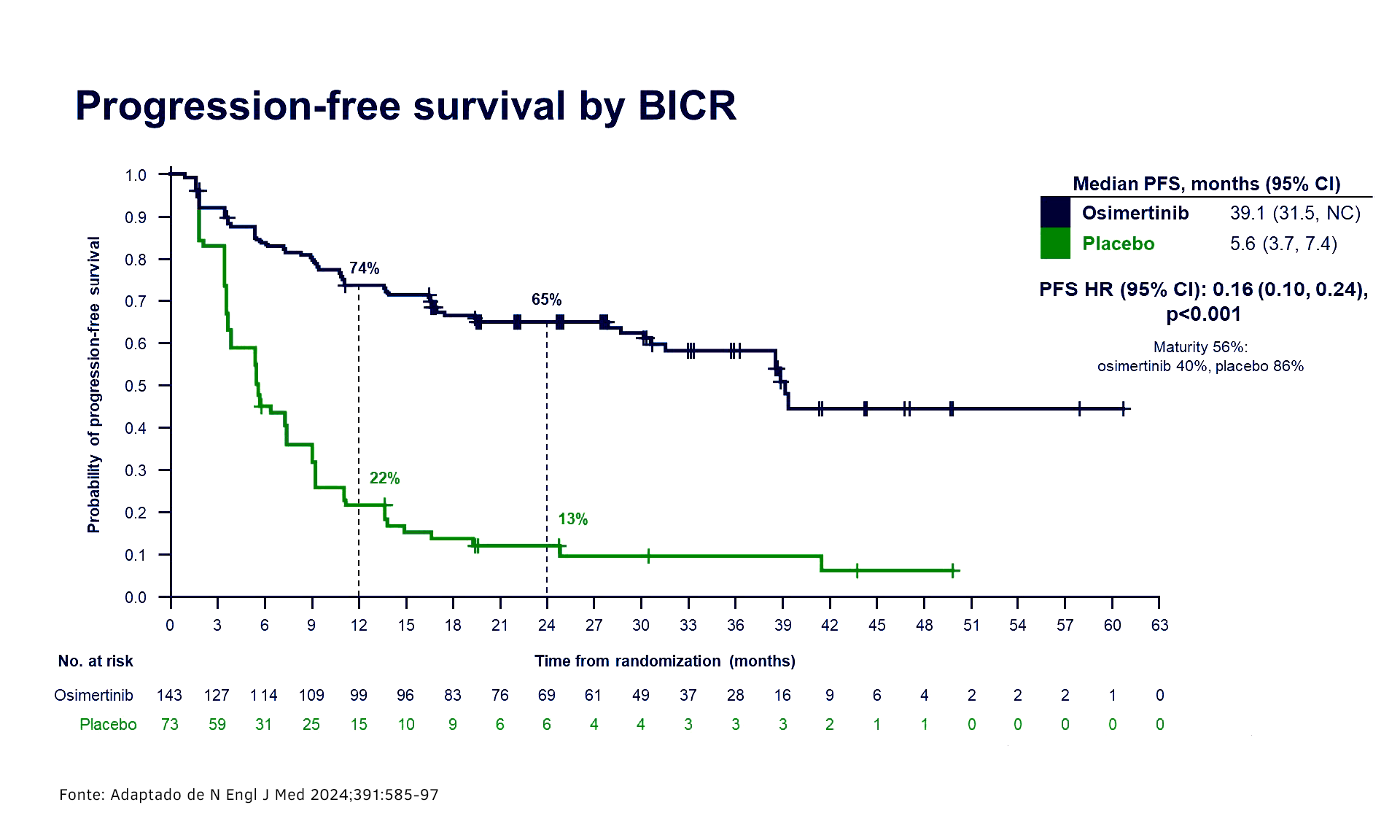
“Esses resultados são extremamente importantes. Os gráficos de sobrevida livre de progressão mostram que o tratamento de consolidação com osimertinibe teve benefício clínico e estatisticamente significativo em uma população de pacientes com natureza bastante agressiva de progressão da doença. Aos dois anos, 74% dos que receberam osimertinibe de consolidação estavam sem evidência de progressão, versus apenas 13% no braço controle”, destaca William, líder nacional de Oncologia Torácica do Grupo Oncoclínicas. “Quando olhamos para o braço controle, vemos que a grande maioria desses pacientes provavelmente apresenta doença micrometastática e vai progredir rapidamente. Nesse contexto de doença sistêmica, o uso de osimertinibe por prazo indeterminado é bastante justificado”, analisa.
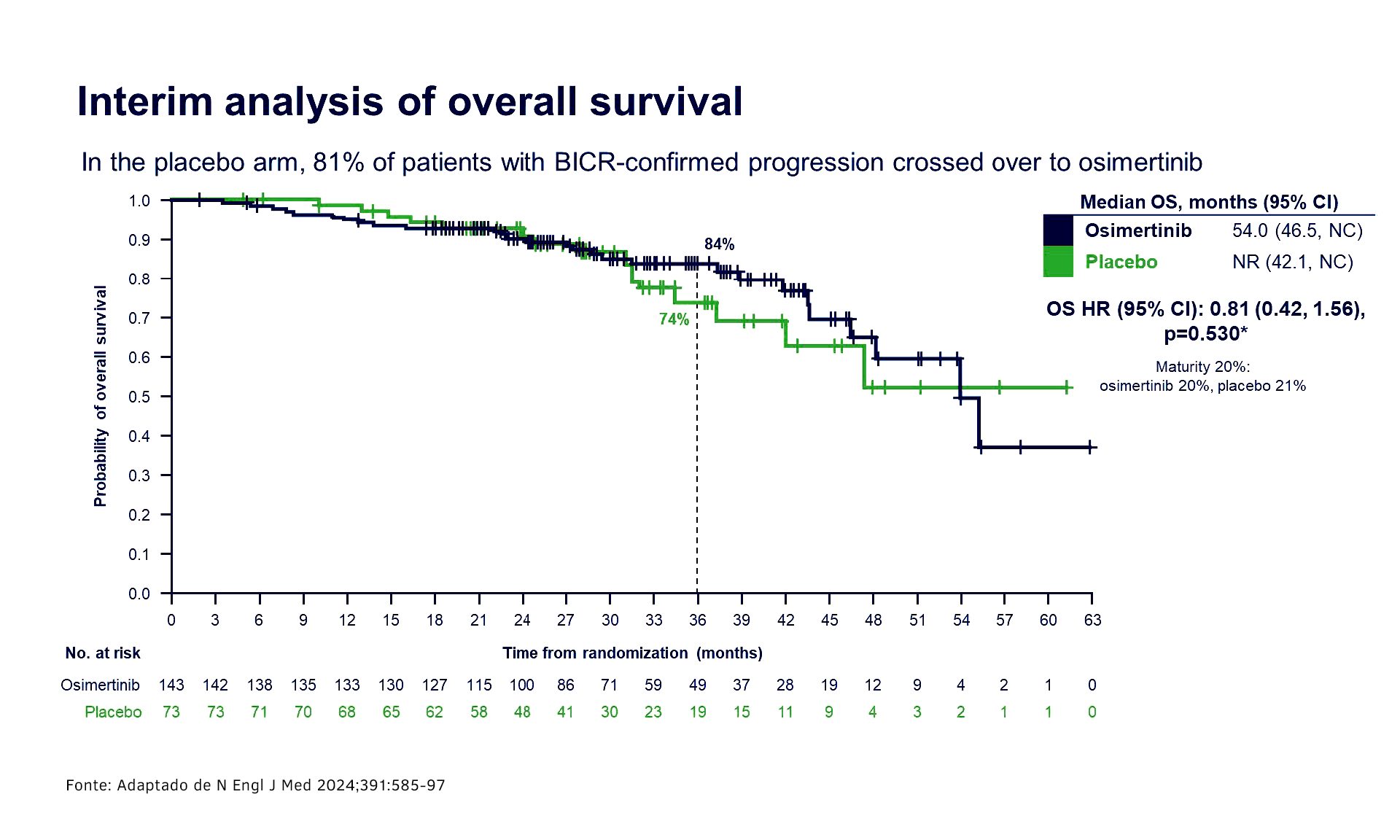
A análise de sobrevida global interina (maturidade de 20%) mostrou tendência a favor de osimertinibe (HR 0,81; IC de 95% 0,42, 1,56; p = 0,530); 81% dos pacientes com QRT isolada fizeram cross over e receberam osimertinibe após a progressão.
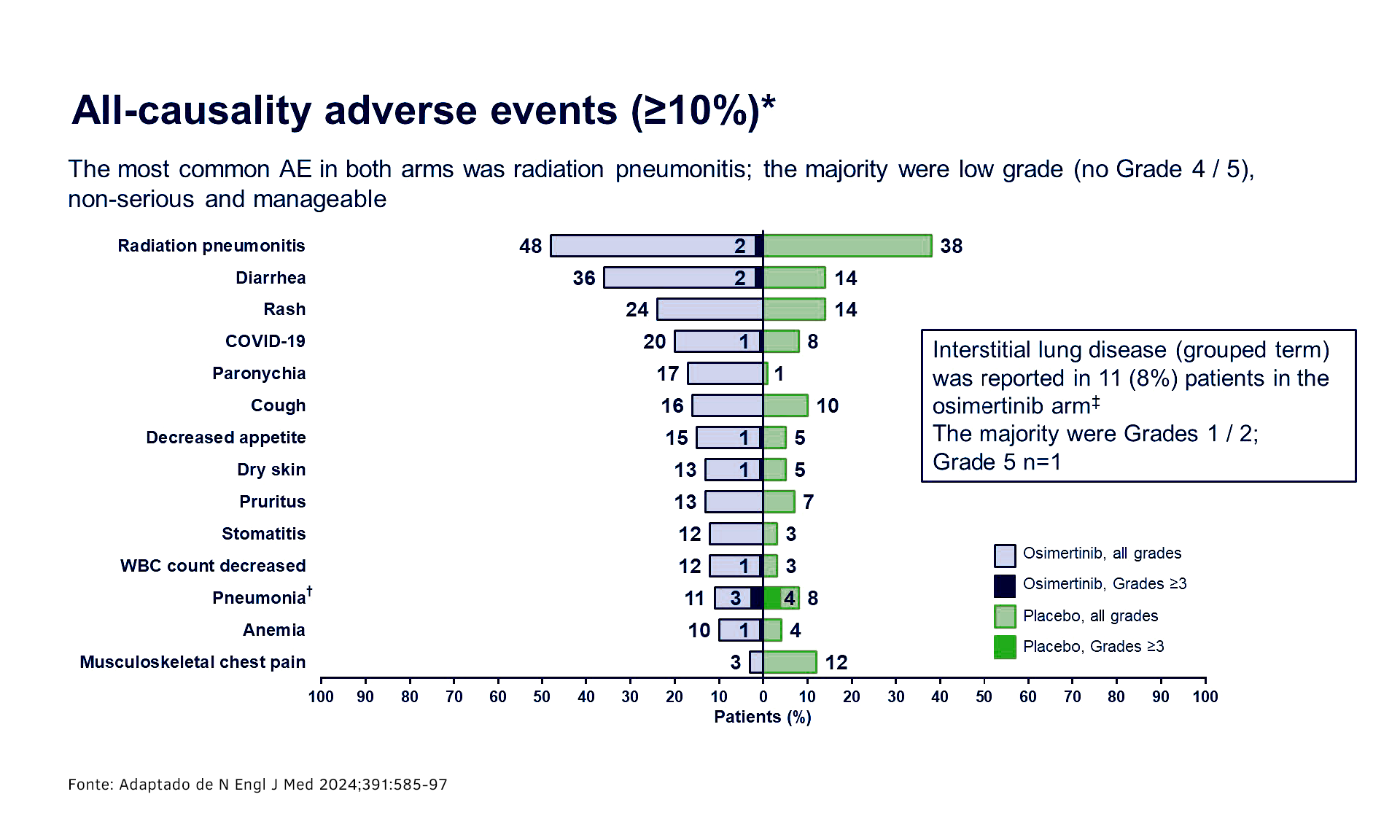
Em relação à segurança e tolerabilidade, eventos adversos foram relatados em 98% vs 88% dos pacientes nos grupos com osimertinibe vs QRT isolada, respectivamente. Eventos adversos (EAs) de grau ≥ 3 ocorreram em 35% vs 12%; EAs de pneumonite por radiação (termo agrupado): 48% (osimertinibe) vs 38% (PBO), maioria Grau 1/2. Quaisquer EAs que levaram à descontinuação foram relatados em 13% vs 5% para osimertinibe vs QRT isolada, respectivamente.3
Em conclusão, osimertinibe após quimiorradioterapia definitiva demonstrou melhora clínica e estatisticamente significativa na SLP em pacientes com CPCNP EGFRm estágio III irressecável, sem sinais de segurança inesperados. Esses resultados estabelecem osimertinibe como o novo padrão de tratamento para CPCNP EGFRm neste cenário2.
Com cerca de 2,3 milhões de casos e 1,8 milhão de mortes em 2020, o câncer de pulmão é uma das principais causas de mortes por câncer em todo o mundo. No Brasil, aproximadamente 28 mil mortes relacionadas ao câncer de pulmão foram registradas em 2020. O câncer de pulmão de células não pequenas é o subtipo mais comum, responsável por aproximadamente 80%-90% de todos os casos.
Vídeo:
Estudo LAURA e o tratamento do CPNPC com mutação em EGFR localmente avançado irressecável
O oncologista William Nassib William Jr., líder de oncologia torácica do grupo Oncoclinicas, apresenta em vídeo os principais dados do estudo LAURA, que embasou a indicação do osimertinibe pela ANVISA como terapia de consolidação após quimiorradioterapia definitiva em pacientes com câncer de pulmão células não pequenas (CPCNP) estágio III irressecável com deleção do éxon 19 do EGFR ou mutação L858R do éxon 21. “Os gráficos de sobrevida livre de progressão mostram que o tratamento de consolidação com osimertinibe teve benefício clínico e estatisticamente significativo em uma população de pacientes com natureza bastante agressiva de progressão da doença”, explica ele. Assista.
Referências:
- MINISTÉRIO DA SAÚDE. ANVISA. Diário Oficial da União ed Nº 75. Resolução-RE Nº 1.521, de 16 de abril de 2025. Publicação de inclusão de nova indicação de osimertinibe, secção 1, pág. 67-71. Publicada em 22 de abril de 2025.
- Abstract #: LBA4 - Osimertinib (osi) after definitive chemoradiotherapy (CRT) in patients (pts) with unresectable stage (stg) III epidermal growth factor receptor-mutated (EGFRm) NSCLC: Primary results of the phase 3 LAURA study DOI: 10.1200/JCO.2024.42.17_suppl.LBA4
- Osimertinib after chemoradiotherapy in stage III EGFR-mutated NSCLC
N Engl J Med. 2024; 391:585-97 - Megan E. Daly et al., Management of Stage III Non–Small Cell Lung Cancer: ASCO Guideline Rapid Recommendation Update. JCO 42, 3058-3060(2024). DOI:10.1200/JCO-24-01324
- Montella T, Zalis M, Zukin M, Cordeiro de Lima VC, Baldotto C, De Marchi P, Salles P, Mathias C, Barrios C, Kawamura C, Calabrich A, Araújo LH, Castro G, Bustamante C, Santa Maria A, Reis M, Ferreira CG. EGFR Mutation Detection in Brazilian Patients With Non-Small-Cell Lung Cancer: Lessons From Real-World Data Scenario of Molecular Testing. JCO Glob Oncol. 2023 Sep;9:e2200426. doi: 10.1200/GO.22.00426. PMID: 37769218.




