 Com a ampliação da indicação do tratamento neoadjuvante no câncer de mama inicial HER2+, a desintensificação do tratamento cirúrgico passou a ser muito comum, permitindo em boa parte dos casos a cirurgia conservadora. Da mesma maneira, a radioterapia hipofracionada tornou-se a modalidade de escolha, minimizando os efeitos adversos e tornando o tratamento radioterápico mais cômodo e com menor custo. Também em relação ao tratamento sistêmico há fortes evidências favorecendo a estratégia. Em artigo de revisão, Afonso Celso Pinto Nazário e colegas analisam os principais estudos e sua base racional na “desintensificação” do tratamento cirúrgico, radioterápico e sistêmico, assim como perspectivas de tratamento na doença invasiva da mama localizada HER2+.
Com a ampliação da indicação do tratamento neoadjuvante no câncer de mama inicial HER2+, a desintensificação do tratamento cirúrgico passou a ser muito comum, permitindo em boa parte dos casos a cirurgia conservadora. Da mesma maneira, a radioterapia hipofracionada tornou-se a modalidade de escolha, minimizando os efeitos adversos e tornando o tratamento radioterápico mais cômodo e com menor custo. Também em relação ao tratamento sistêmico há fortes evidências favorecendo a estratégia. Em artigo de revisão, Afonso Celso Pinto Nazário e colegas analisam os principais estudos e sua base racional na “desintensificação” do tratamento cirúrgico, radioterápico e sistêmico, assim como perspectivas de tratamento na doença invasiva da mama localizada HER2+.
Autores: Afonso Celso Pinto Nazario1, Vanessa Monteiro Sanvido2, Davi Jing Jue Liu3, Rodrigo Souza Dias4
1 - Professor Livre-Docente da Disciplina de Mastologia da EPM-UNIFESP. Coordenador do Programa de Pós-Graduação do Departamento de Ginecologia da EPM-UNIFESP. Vice-Coordenador da Câmara de Pós-Graduação e Pesquisa da EPM-UNIFESP
2 - Mestre e Doutoranda da Disciplina de Mastologia da EPM-UNIFESP
3 - Oncologista clínico do Ambulatório de Onco-Mastologia da Disciplina de Mastologia da EPM-UNIFESP
4 - Professor Adjunto-Doutor do Departamento de Oncologia Clínica e Experimental da EPM-UNIFESP, Coordenador do Setor de Radioterapia da EPM-UNIFESP
Resumo: Abordaremos aqui os principais estudos e sua base racional na “desintensificação” do tratamento cirúrgico, radioterápico e sistêmico, assim como perspectivas de tratamento na doença invasiva da mama localizada HER2+. Usa-se aqui o termo desintensificar não no sentido de enfraquecer a eficácia do tratamento, mas de reduzir a intensidade (“de-escalating”) da terapêutica, mantendo sua eficiência.
Com a ampliação da indicação do tratamento neoadjuvante no câncer de mama inicial HER2+, a desintensificação do tratamento cirúrgico passou a ser muito comum, permitindo em boa parte dos casos a cirurgia conservadora. Da mesma maneira, a radioterapia hipofracionada tornou-se a modalidade de escolha, minimizando os efeitos adversos, tornando o tratamento radioterápico mais cômodo e com menor custo. Em relação ao tratamento sistêmico, há fortes evidências favorecendo o uso de paclitaxel e trastuzumabe na adjuvância da doença inicial; nos casos sem envolvimento linfonodal, a adição de pertuzumabe não agregou benefício. O uso de trastuzumabe por 6 meses parece não ser inferior ao regime tradicional de 12 meses na doença inicial, entretanto, estudos mais robustos são necessários.
Palavras-chave: Câncer de mama, Tratamento, Her2+
Cirurgia
No câncer de mama invasivo HER2 superexpresso, com a quimioterapia e terapia-alvo neoadjuvantes, a taxa de resposta clínica que permite a cirurgia conservadora é bastante elevada, e a resposta patológica completa também é bem expressiva, atingindo cifras de até 66% 1. Assim, a desintensificação do tratamento da doença HER-2+ começou com o tratamento cirúrgico mamário, precedido do tratamento neoadjuvante.
Já em relação à abordagem axilar nos casos de comprometimento linfonodal mínimo, por ser o câncer de mama HER2+ uma doença mais agressiva, questionou-se se seria necessária a linfonodectomia axilar.
O ACOSOG Z0011 foi um ensaio clínico randomizado, Fase III, multicêntrico, de não-inferioridade, no qual foram incluídas mulheres com câncer de mama invasivo de até 5 cm (T1 e T2), axila clinicamente negativa tratadas com cirurgia conservadora com margens negativas (ausência de tumor na tinta) e até dois linfonodos sentinelas metastáticos diagnosticados por hematoxilina e eosina (H&E), por meio da biópsia do linfonodo sentinela. Foram excluídas do estudo pacientes com estes critérios: metástase axilar diagnosticada inicialmente ou isoladamente pela imuno-histoquímica, três ou mais linfonodos sentinelas positivos, linfonodos conglomerados, extravasamento capsular extenso, doença multicêntrica, tratamento neoadjuvante, gestantes e lactantes, câncer de mama bilateral ou antecedente pessoal de outra neoplasia maligna com intervalo menor de cinco anos 2,3.
Em seguimento médio de 6,3 anos, a biópsia do linfonodo sentinela (BLS) sem tratamento adicional – comparada à linfonodectomia axilar (LA) – não resultou em diferença estatística na sobrevida global e na sobrevida livre de doença. Nesse período foram identificados apenas 94 óbitos (52 no grupo LA e 42 no grupo BLS) 3.
Uma das limitações foi a avaliação do status HER2. O estudo teve início em 1999, quando o teste não era de rotina e a efetividade de trastuzumabe nesse tipo biológico era desconhecida. Entretanto, presume-se que a distribuição dos casos HER2 positivos tenha sido equilibrada entre os dois braços do estudo.
Em 2017 foi publicado o resultado com seguimento de dez anos. A sobrevida global nesse período foi de 86,3% no grupo BLS e de 83,6% no grupo LA, (HR 0,85; IC 95% 0 – 1,16; não-inferioridade p = 0,02). O seguimento médio foi de 9,3 anos, sendo notificados 110 óbitos, constituídos de 51 no grupo BLS e 59 no grupo LA. A sobrevida livre de doença em dez anos foi, respectivamente, de 80,2% e 78,2% (HR 0,85; IC95% 0,62 – 1,17; p = 0,32). Entretanto, a sobrevida em dez anos dos pacientes sem linfonodectomia axilar não foi inferior ao grupo tratado com a dissecção axilar 4.
A recorrência locorregional no seguimento médio de 9,25 anos do ACOSOG Z0011 foi identificada somente em 39 pacientes. Não houve diferença significativa entre os grupos, com 6,2% no LA e 5,3% no BLS, com p = 0,36. A recorrência regional também não diferiu entre os grupos; no período de cinco a dez anos de seguimento, foi identificada apenas uma recorrência regional no grupo BLS, e nenhuma no grupo LA 4. A incidência cumulativa de recorrência regional em dez anos foi de duas pacientes (0,5%) no grupo LA, comparada com cinco pacientes (1,5%) no grupo BLS. Somente uma recorrência local no grupo BLS ocorreu após dez anos. A incidência cumulativa de recorrência local em dez anos foi de 19 (5,6%) e 12 (3,8%) pacientes, respectivamente, no grupo LA e BLS (p = 0,13). O tempo médio de recorrência loco-regional, regional e local foi, respectivamente, de 3,1 anos, 4,0 anos e 3,1 anos. O que pode ser concluído é que o tempo de seguimento do estudo foi suficiente para identificar o evento (recorrência) 5.
Realizamos na EPM-UNIFESP estudo caso-controle, com pacientes com carcinoma de mama primário invasivo e axila clinicamente negativa, tratadas com cirurgia conservadora de mama e BLS entre fevereiro de 2008 e dezembro de 2018. As pacientes com linfonodo sentinela metastático foram tratadas somente com BLS ou com LA 6.
Não houve diferença na sobrevida global, que foi de 80,1% no grupo BLS e 87,5% no LA (p=0,376). A taxa de recorrência loco-regional também não diferiu entre os grupos, que foi de 1,8 no grupo BLS e de 7,7% no grupo de LA (p=0,196) (Figuras 1 e 2)
A prescrição de terapia-alvo com trastuzumabe para as pacientes com HER2 superexpresso começou no nosso serviço em 2009. O estudo iniciou-se em 2008 e nenhuma paciente entre 2008 e 2009 com HER2 superexpresso apresentou BLS positiva, ou seja, todas as pacientes incluídas na pesquisa com HER2 positivo já fizeram uso da medicação. Nas pacientes com HER2 superexpresso não houve diferença na sobrevida em relação aos tumores HER2 negativos, e essa característica foi homogênea entre os braços com e sem linfonodectomia axilar (Tabela 1)
Figura 1. Sobrevida global (em anos) de pacientes com câncer de mama submetidas à linfonectomia axillar (ALND, linha verde) ou biópsia do linfonodo sentinela (SNLD), linha vermelha); p = 0,376 6
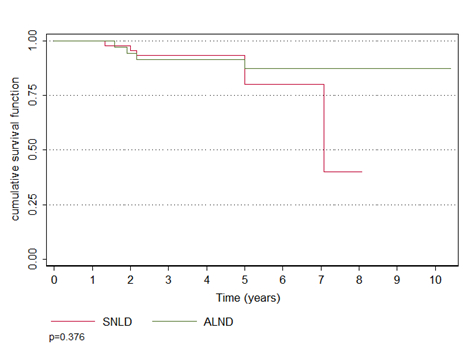
Figura 2. Recorrência loco-regional de pacientes com câncer de mama submetidas à linfonectomia axillar (ALND, linha verde) ou biópsia do linfonodo sentinela (SNLD), linha vermelha); p = 0,196 6
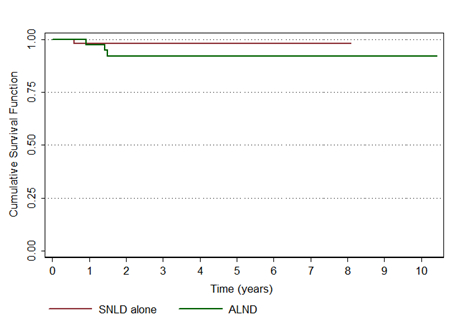
Tabela 1 – Análise da sobrevida global e em pacientes com HER-2+ (modelo de Kaplan-Meier) de pacientes com câncer de mama submetidas à linfonodectomia axillar (LA) ou somente biópsia do linfonodo sentinela (BLS) 6
|
Sobrevida acumulada ( %) |
p* |
||||
|
1 ano |
2 anos |
5 anos |
10 anos |
||
|
Total |
100,0 |
9,2 ± 2,3 |
84,9 ± 5,0 |
79,3 ± 7,2 |
- |
|
Grupo |
0,376 |
||||
|
Somente BLS |
100,0 |
95,8 ± 2.9 |
80,1 ± 9,3 |
- |
|
|
LA |
100,0 |
94,5 ± 3,8 |
87,5 ± 6,0 |
87,5 ± 6,0 |
|
|
Imuno-histoquímica (HER2) |
0,432 |
||||
|
HER 2 - |
100,0 |
94,9 ± 2,5 |
84,0 ± 5,3 |
78,4 ± 7,3 |
|
|
HER 2 + |
100,0 |
100,0 |
100,0 |
- |
|
Nas pacientes que receberam quimioterapia e terapia-alvo neoadjuvantes e em que houve de-escalonamento de N1-2 para N0, discute-se também se seria possível a realização de apenas a BLS ou se seria imprescindível a linfonodectomia axilar. De forma geral, neste cenário, a taxa de falso-negativo em alguns ensaios clínicos foi elevada; entretanto, se a BLS for feita com dupla marcação (azul patente e tecnécio), ou se forem ressecados pelo menos 3 linfonodos sentinelas, ou, aindam se for realizada ultrassonografia após o tratamento neoadjuvante e antes da cirurgia e esta não revelar linfonodos não habituais ou atípicos, a taxa de falso-negativo atinge níveis adequados e o procedimento poderia ser realizado 7,8 .
Radioterapia
No câncer de mama, a radioterapia é usualmente empregada como terapia adjuvante à cirurgia conservadora ou mastectomia, propiciando redução significativa da recidiva loco-regional e da mortalidade câncer especifica 9,10. Quando utilizado o fracionamento convencional com dose total de 45-50 Gy e frações de 1,8-2 Gy/dia, muitas vezes seguido de reforço de dose no leito operatório (boost), a duração do curso de radioterapia pode chegar a 6 semanas, o que causa impacto social, profissional e econômico11. Além disso, pode também cursar com reações agudas como radiodermite, edema, dor e efeitos tardios como fibrose subcutânea e alterações cardíacas. Dessa forma, o objetivo da desintensificação do tratamento seria de oferecer terapêutica igualmente eficaz, reduzindo os impactos causados com o fracionamento convencional. A seguir, abordaremos as principais estratégias que podem ser utilizadas com esse intuito em pacientes com câncer de mama HER2+.
Hipofracionamento
A radioterapia hipofracionada consiste no uso de um menor número total de aplicações com maior dose por fração quando comparada ao fracionamento convencional. Do ponto de vista radiobiológico, acredita-se que o câncer de mama apresente resposta à radiação mais semelhante aos tecidos de resposta lenta e, portanto, seja mais sensível ao aumento da dose por fração.
Estudos randomizados, como o conduzido pelo Ontario Clinical Oncology Group (OCOG) e os trials START-A e START-B, mostraram que a radioterapia hipofracionada na mama oferece resultados comparáveis em termos de controle local ao fracionamento convencional e menos efeitos adversos como fibrose da mama, redução do volume mamário, telangiectasias e edema da mama 12,13,14. Em 2011, a ASTRO recomendava a utilização do hipofracionamento para pacientes com idade maior que 50 anos, com tumores T1-2N0 tratados com cirurgia conservadora e sem quimioterapia. Desta forma, a maior parte das pacientes com câncer de mama HER2+ não preencheriam os critérios para utilização do hipofracionamento, uma vez que receberiam quimioterapia e terapia anti-HER2. Com a publicação de estudos avaliando o hipofracionamento nos diferentes subtipos moleculares, verificou-se que tal característica não constitui fator preditivo de resposta ao hipofracionamento, podendo a radioterapia hipofracionada ser oferecida de forma segura para as pacientes HER2+ 15,16. Em 2018, a ASTRO atualizou suas recomendações para o uso do hipofracionamento, e restrições como idade, estádio e quimioterapia foram excluídas, ficando a decisão em relação à oferta da radioterapia hipofracionada independente dos receptores hormonais e status HER2 17.
Publicações mais recentes avaliaram esquemas de fracionamento ainda mais curtos, utilizando apenas 5 frações. No estudo UK FAST, as taxas de recorrência local em 10 anos variaram de 0,7% (50 Gy em 25 frações) a 1,7% (28,5 Gy em 5 frações, 1 vez por semana). Em relação aos efeitos adversos observados na mama, não houve diferença entre a dose de 28,5 e 50 Gy. Estudo similar (UK FAST FORWARD) comparou o esquema de 40 Gy em 15 frações a 26 Gy ou 27 Gy em 5 frações em 1 semana. Neste estudo, em que 10% das 4096 pacientes avaliadas apresentavam positividade para HER2, o tratamento com dose de 26 Gy em 5 frações não se mostrou inferior a 40 Gy em 15 frações, tanto em termos de recorrência como em efeitos adversos 18,19.
Em estudo publicado em 2020, que avaliou mais de 8 mil pacientes tratadas com radioterapia na mama toda, dor mamária moderada ou severa foi observada em 28,9% das pacientes que receberam hipofracionamento contra 45,7% das pacientes do grupo de fracionamento convencional, estando também o fracionamento convencional associado à maior toxicidade aguda20. Considerando o acima exposto, a radioterapia hipofracionada da mama deve ser tratamento de escolha, independente do esquema a ser utilizado, uma vez que reduz o tempo de tratamento, minimiza o risco de efeitos adversos, além do menor custo.
Radioterapia Parcial de mama (APBI)
A radioterapia parcial de mama (APBI) consiste na irradiação da cavidade cirúrgica com 1 a 2 cm de margem, com utilização de maiores doses por fração. Uma das vantagens seria de oferecer tratamento mais curto e de menor custo, além de minimizar complicações. Não existem estudos prospectivos avaliando APBI especificamente no grupo de paciente com status HER2+. Quando analisados estudos prospectivos de APBI, as pacientes com HER2+ estão pouco representadas.
Estudo NSABP B-39/ RTOG 0413 avaliou 4216 pacientes randomizadas para radioterapia em mama toda e APBI utilizando braquiterapia ou teleterapia. Nesse estudo, 19% das pacientes apresentavam receptores hormonais negativos, porém status HER2 não foi avaliado. A falha local em 10 anos foi de 3,9% no grupo de radioterapia em toda mama contra 4,6% com APBI, não preenchendo o critério para equivalência entre os dois tratamentos 21. No estudo IMPORT-LOW, a radioterapia na mama toda (40 G em 15 frações) foi comparada com um grupo com dose reduzida (36 Gy em 15 frações) e um grupo de radioterapia parcial de mama (40 Gy em 15 frações). Apenas 4% dos casos apresentavam HER2+. Os dois braços experimentais se mostraram não- inferiores ao grupo controle em relação à falha local, com menor incidência de alteração no aspecto da mama no grupo de radioterapia parcial 22.
Estudo Fase III de Florença comparou os resultados da radioterapia em mama toda com APBI. Aproximadamente 3,5% das pacientes foram classificadas como HER2+. Recorrência ipsilateral em 10 anos foi de 2,5% no grupo de radioterapia em mama toda contra 3,7% no grupo de APBI e a toxicidade tanto aguda como tardia foi menor com APBI 23. No trial TARGIT-A em que a radioterapia na mama toda foi comparada com a radioterapia parcial realizada de forma intra-operatória, em torno de 15% das pacientes apresentavam HER2+. Neste estudo, não foi observada diferença significativa em termos de sobrevida livre de recorrência, sobrevida câncer especifica e sobrevida global entre os 2 grupos 24.
Seguindo os critérios da ASTRO, as pacientes candidatas a APBI seriam aquelas com mais de 50 anos, com margens negativas ≥ 2mm, com tumores Tis ou T125. Pacientes que apresentam receptores hormonais negativos são classificadas no grupo em que a APBI deve ser utilizada com cautela. Já a GEC-ESTRO e ABS não consideram receptores hormonais negativos como contraindicação para tal técnica de tratamento 26,27.
De forma geral, pode-se dizer que a APBI oferece bom controle local, discretamente inferior a radioterapia em mama toda, porém sem prejuízo na sobrevida global 28,29. Em pacientes com tumores HER2+, até a publicação de estudos randomizados nesse grupo específico de pacientes, a APBI deve ser utilizada com cautela.
Omissão do boost
O reforço de dose no leito tumoral, também chamado de boost, baseia-se no fato de que 65 a 80% das recidivas ocorrem nesta localização. A administração do boost, em estudo do EORTC, promoveu redução da recorrência local em 10 anos de 10,2% para 6,2% para pacientes com margens negativas 30. Conforme guideline da ASTRO, o boost deve ser utilizado em pacientes com tumores invasivos tratadas com cirurgia conservadora e que apresentem pelo menos um dos seguintes critérios: idade ≤ 50 anos, idade entre 51 a 70 anos com tumores de alto grau, ou margens positivas 31. Suas principais inconveniências incluem efeitos agudos como mais reação de pele e edema de mama, além do tratamento mais longo, e a longo prazo mais fibrose e pior resultado cosmético 32.
Em estudo publicado recentemente, avaliando o papel do boost em 1082 pacientes incluídas no HERA trial tratadas com cirurgia conservadora e trastuzumabe, observou-se com follow-up mediano de 11 anos, incidência de recorrência local de 6,3% no grupo que recebeu boost e de 7,8% no grupo sem boost, diferença que não foi estatisticamente significante. Apesar de tal publicação se basear em análise não planejada de subgrupo do HERA trial em que a utilização do boost não foi randomizada, tal estudo evidencia que as pacientes com câncer de mama HER2+ tem um baixo índice de falha local quando recebem terapia anti-HER2 e que nesse grupo de pacientes, talvez o boost possa ser omitido 33.
Tratamento sistêmico
O tratamento contra o câncer de mama HER2+ tem passado por significativos avanços nos últimos anos graças ao surgimento de novas drogas, estratégias e combinações de tratamento sistêmico. Hoje não existe uma abordagem única na doença invasiva localizada HER2+. As principais indicações combinam quimioterapia à base de taxanos com terapia-alvo anti-Her2 no cenário de neoadjuvância, como a combinação de THP ou TCHP entre outras.
Essas estratégias têm como objetivo reduzir o volume do tumor, tornando um caso inoperável em operável, ou um caso operável inicialmente por cirurgia radical para operável por cirurgia conservadora, diminuindo a morbidade cirúrgica, além de permitir a avaliação de resposta e sensibilidade da doença à quimioterapia neoadjuvante para, assim, estabelecer também terapias de potencial benefício adjuvante.
Nesse sentido, muitos estudos têm surgido para responder quais pacientes se beneficiam de estratégias menos intensas, como por exemplo redução do tempo de exposição a agentes anti-HER2, uso de monoterapias-alvo, e redução de agentes citotóxicos, e quais pacientes necessitam de tratamentos mais amplos e agressivos.
Combinação de agentes anti-HER2: Pertuzumabe + Trastuzumabe necessariamente?
O estudo APHINITY analisou em 5805 pacientes a adição de pertuzumabe ao esquema de quimioterapia com trastuzumabe em doentes com HER2+ versus placebo. Foram incluídas pacientes que não possuíam acometimento linfonodal e com tumor maior que 1 cm, como também aquelas que apresentavam acometimento linfonodal axilar. As doentes com tumor entre 0,5 cm e 1 cm necessitavam de fatores de risco como grau nuclear 3, negatividade de receptor endócrino ou idade menor que 35 anos para serem incluídas. Na população com linfonodo negativo, a adição de pertuzumabe após análise de 48 meses na sobrevida livre de progressão revelou 32 eventos de progressão vs 29 no grupo de placebo com HR de 1,13 (95% IC 0,68-1,86) com p=0,64 34. Já no grupo com linfonodo positivo, houve significância estatística no benefício de adição de pertuzumabe, com HR de 0,77 (95% IC, 0,62-0,96) p=0,02. O benefício da adição de pertuzumabe foi principalmente observado nos pacientes com envolvimento linfonodal, corroborado por análise de seguimento após seis anos do ensaio 35.
O benefício da redução da intensidade do tratamento em pacientes com HER2+ e doença localizada foi observado também na análise de seguimento de 7 anos do ensaio APT (Adjuvant Paclitaxel and Trastuzumab Trial) 36. As pacientes estudadas apresentavam doença com linfonodo negativo e dimensão de até 3cm, sendo que o perfil convergia para predominância de doentes com receptores endócrinos positivos e doença de até 2cm. Após seguimento de 7 anos, a sobrevida livre de progressão foi de 93% (95% IC 90,4 - 96,2) e a sobrevida global de 95% (95% IC 92,4 - 97,7). Isso revela um desfecho excelente com tratamento de paclitaxel de 12 semanas associado a 12 meses de trastuzumabe em pacientes de baixo risco com doença predominantemente em estágio 1 37. Portanto, há evidências que favorecem o tratamento com paclitaxel e trastuzumabe em pacientes com estadiamento I e baixo risco, e a não adição de pertuzumabe em ausência de envolvimento linfonodal.
O uso de adjuvância com TDM1 em monoterapia está sendo estudado pelo ensaio ATEMPT (NCT01853748), que compara essa estratégia versus paclitaxel e trastuzumabe combinados para avaliar eventos de progressão e toxicidade. O fundamento racional deste estudo baseia-se no reconhecimento da necessidade de adjuvância em neoplasias invasivas estágio I HER+ superexpresso, enquanto procura reduzir a intensidade do tratamento com base na análise tardia do estudo APT, que revelou benefício na combinação de paclitaxel e trastuzumabe. De modo geral, TDM1 é um tratamento que parece ser mais tolerável com perfil de toxicidade menor do que a combinação de quimioterapia com trastuzumabe. O primeiro desfecho foi encontrado com sobrevida livre de progressão de 97,7% em três anos (p<0.0001). Embora o ensaio não tenha sido desenhado para comparação entre os dois braços, a sobrevida livre de progressão no braço de TH foi de 92,8%. Em termos de efeitos colaterais, a incidência foi de 46% em ambos os grupos, com diferença de neurotoxicidade predominante em TH e trombocitopenia e alterações de função hepática no TDM1 38. O uso de TDM1 pode ser considerado em perfis específicos de pacientes, a partir do padrão de toxicidade diferente de TH.
Duração de terapia HER2: 9 semanas, 6 meses, 12 meses
Em termos de duração de terapia HER2, o estudo HERA demonstrou que a extensão para dois anos de tratamento não trouxe benefício quando comparado ao uso de um ano 39. A análise tardia após 11 anos do estudo reafirmou o benefício de 12 meses de trastuzumabe depois da quimioterapia 40. Muitos estudos têm procurado responder se para pacientes selecionados, um período menor de trastuzumabe poderia se traduzir em efeito equivalente associado ao benefício da redução de toxicidade. O estudo de não-inferioridade Persephone recrutou pacientes para avaliar comparativamente a exposição de 6 meses vs 12 meses de trastuzumabe. A maioria das pacientes possuíam receptor endócrino positivo e doença sem envolvimento linfonodal. Na análise de 4 anos o grupo que fez uso de 6 meses de tratamento apresentou sobrevida livre de progressão de 89,4% (95% IC 87,9 - 90,7) versus 89,8% (90% IC 88.3 - 91,1) HR 1,07 e p=0,011. Em relação a efeitos colaterais severos, houve evidência de menor incidência de 19% versus 24% dos pacientes estudados p=0,0002, assim como em cardiotoxicidade de 3% versus 8% p<0,0001 41.
Alguns procuraram estudar o benefício de 9 semanas de trastuzumabe versus 12 meses, mas falharam em demonstrar não-inferioridade 42,43. Com base nestes estudos, uma metanálise buscou analisar dados de 11.376 pacientes extraídos de cinco estudos clínicos que compararam durações de 9 semanas a 6 meses versus 1 ano de tratamento. A análise permitiu concluir não-inferioridade em esquemas mais breves de tratamento, tanto em sobrevida global quanto em sobrevida livre de progressão, com benefício em menor toxicidade de 3,9% vs 6,9% RR=0.53 44.
Até o momento, as evidências disponíveis apontam para uma tendência de benefício de não-inferioridade na exposição de 6 meses de trastuzumabe em contexto de adjuvância, embora os dados ainda sejam conflitantes e exista a necessidade de maior maturidade dos estudos.
Tumores iniciais que não desenvolveram resposta patológica completa após neoadjuvância: Neratinibe e TDM1
Sabemos por meio de muitos estudos que a resposta patológica completa após neoadjuvância é um importante marcador prognóstico, e que a ausência desta resposta leva a potencial necessidade de intensificação de tratamento por medidas adjuvantes 45,46.
O estudo ExteNET analisou o uso de neratinibe versus placebo em pacientes HER2+ com doença localizada e localmente avançada após tratamento com trastuzumabe em contexto de adjuvância. O benefício foi observado em sobrevida livre de progressão com 116 eventos vs 163 eventos no grupo placebo, HR 0,73 (95% IC 0,57 - 0,92) p=0,0083 47. Entretanto, o desenho do estudo não permitiu determinar se há benefício em submeter a tratamento adjuvante com neratinibe pacientes que já obtiveram resposta patológica completa após neoadjuvância, de modo que essa informação ainda não é conhecida até o momento. Já o estudo KATHERINE recrutou pacientes tratados com esquema neoadjuvante com trastuzumabe e randomizou apenas aqueles que não obtiveram resposta patológica completa. Estes pacientes que não obtiveram resposta patológica completa foram divididos entre TDM1 e trastuzumabe, e os que receberam TDM1 obtiveram sobrevida livre de progressão significativamente melhor, em 3 anos de 88,3% vs 77% no grupo de trastuzumabe e HR de 0,50 (95% IC 0,39 – 0,64) p<0,001 48.
A análise destes estudos revela que tendência a desintensificação de tratamentos adjuvantes em pacientes que obtiveram resposta patológica completa em neoadjuvância.
Tumores iniciais que não desenvolveram resposta patológica completa após neoadjuvância: menos quimioterapia
A resposta patológica completa após neoadjuvância levanta a dúvida sobre o benefício de quimioterapia adjuvante. O ensaio CompassHER2-pCR irá recrutar pacientes para tratamento neoadjuvante e estudar a desintensificação naqueles que obtiverem resposta patológica completa sem a administração de quimioterapia adicional 49.
Diferenças em subtipos moleculares, biomarcadores e direções futuras
A compreensão mais precisa da biologia dos tumores HER2+ pode trazer elementos de personalização de tratamento e desintensificação. Sabemos que no grupo de HER2+ existem múltiplos subtipos biológicos intrínsecos, como Luminal A e Luminal B, além dos HER2 puros, o que tem implicações na prática clínica. Parece haver uma tendência de índices maiores de resposta patológica completa em pacientes com HER2 puros quando comparados aos Luminais 50. Ao mesmo tempo, os pacientes HER2 puros apresentam pior sobrevida livre de progressão quando não atingem a resposta patológica completa observada a partir do estudo CALGB 40601 51.
Outros marcadores podem ser observados como preditores de desfecho, como por exemplo o PIK3CA. O estudo CHER-LOB demonstrou menor benefício de terapia combinada anti-HER2 na presença de mutação de PIK3CA vs pacientes HER2+ que possuíam PIK3CA selvagem 52.
Vale ressaltar que em um contexto tão abrangente de drogas e estudos, o estudo I-SPY2 traz a interessante proposta de avançar na prática de medicina personalizada e de precisão em contexto de neoadjuvância, com múltiplos braços experimentais versus controle com tratamento padrão para avaliar novas drogas-alvo, imunoterapias e quimioterapias 53. Trata-se de uma estratégia em que poderemos observar resultados futuros que permitam um tratamento mais preciso e individualizado.
A doença de mama invasiva inicial HER2+ compreende gama ampla de aspectos a serem estudados, desde particularidades moleculares até combinação e sequência de tratamentos com base nas suas respostas. Em tumores iniciais pequenos, as estratégias de encurtar o período de tratamento adjuvante para 6 meses podem ser válidas, assim como o uso de paclitaxel e trastuzumabe exclusivo. Nas doenças localizadas, pacientes que evoluíram para resposta patológica completa após a neoadjuvância podem ser submetidos a paclitaxel e trastuzumabe somente. T-DM1 pode ser utilizado em pacientes que necessitam de combinação de quimioterapia e agente anti-Her, a depender do perfil de toxicidade.
Referências:
1 - Schneeweiss A, Chia S, Hickish T, Harvey V, Eniu A, Hegg R, et al. Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Annals Oncology: official journal of the European Society for Medical Oncology. 2013;24(9):2278-84
2 - Lucci A, McCall LM, Beitsch PD, Whitworth PW, Reintgen DS, Blumencranz PW, et al. Surgical complications associated with sentinel lymph node dissection (SLND) plus axillary lymph node dissection compared with SLND alonein the American College of Surgeons Oncology Group Trial Z0011. J Clin Oncol. 2007 Aug 20;25(24):3657-63. Epub 2007 May 7
3 - Giuliano AE, Hunt KK, Ballman KV, Beitsch PD, Whitworth PW, Blumencranz PW, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial. JAMA. 2011, Vols. Feb 9;305(6):569-75.
4 - Giuliano AE, Ballman KV, McCall L, Beitsch PD, Brennan MB, Kelemen PR, et al. Effect of Axillary Dissection vs No Axillary Dissection on 10-Year Overall Survival Among Women with Invasive Breast Cancer and Sentinel Node Metastasis: The ACOSOG Z0011 (Alliance) Randomized Clinical Trial. JAMA 2017 Sep 12;318(10):918-926.
5 - Giuliano AE, Ballman K, McCall L, Beitsch P, Whitworth PW, Blumencranz P, et al. Locoregional Recurrence After Sentinel Lymph Node Dissection With or Without Axillary Dissection in Patients With Sentinel Lymph Node Metastases: Long-term Follow-up From the American College of Surgeons Oncology Group (Alliance) ACOSOG Z0011 Randomized T. Ann Surg. 2016, Vols. Sep;264(3):413-20.
6 - Nazario ACP, Elias S, Facina G, Sanvido V. Impact of ACOSOG Z0011 trial at University Hospital in Brazil. Cancer Res. 2019; 80 (4): p4-02-14.
7 - Kuehn T, Bauerfeind I, Fehm T, Fleige B, Hausschild M, Helms G, et al. Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study. Lancet Oncol. 2013;14(7):609-18.
8 - Boughey JC, Suman VJ, Mittendorf EA, Ahrendt GM, Wilke LG, Taback B, et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA. 2013;310(14):1455-61.
9 - Fisher B, Anderson S, Bryant J, et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med. 2002; 347:1233-1241.
10 - Early Breast Cancer Trialists' Collaborative Group (EBCTCG), Darby S, McGale P, Correa C, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomized trials. Lancet. 2011;378(9804):1707-16
11 - Lievens Y. Hypofractionated breast radiotherapy: financial and economic consequences. Breast. 2010; 19:192-7.
12 - Whelan TJ, Pignol JP, Levine MN, et al. Long-Term Results of Hypofractionated Radiation Therapy for Breast Cancer. NEJM .2010; 362;6: 513-520.
13 - Haviland JS, Dewar JA, Agrawal RK, et al. The UK Standardisation of Breast Radiotherapy (START) trials of radiotherapy hypofractionation for treatment of early breast cancer: 10-year follow-up results of two randomised trials. Lancet Oncol. 2013;14(11):1086-1094.
14 - Andrade TRM, Segreto HRC, Segreto RA, Fonseca MCM, Nazario ACP. Meta-analysis of long-term efficacy and safety of hypofractionated radiotherapy in the treatment of early breast câncer. Breast 2019; 48: 24-31.
15 - Bane AL, Whelan TJ, Pond GR, et al. Tumor factors predictive of response of hypofractionated radiotherapy in a randomized trial following breast conserving therapy. Annals of Oncol; 2014:25(5):992-998.
16 - Lalani N, Voduc KD, Jimenez RN, et al. Breast cancer molecular subtype as a predictor of radiation therapy fracationation sensitivity. Int J Radiat Oncol Biol Phys. 2020; S0360-3016(20)34133-X.
17 - Smith BD, Bellon JR, Blitzblau R, et al. Radiation therapy for the whole breast: executive summary of an American Society for Radiation Oncology (ASTRO) evidence-based guideline. Pract Radiat Oncol. 2018;8:145-152.
18 - Brunt AM, Haviland JS, Sydenham M, et al. Ten years results of FAST: a randomized controlled trial of 5-fraction whole breast radiotherapy for early breast cancer. J clin Oncol. 2020. Accessed 18 september 2020, < https://ascopubs.org/doi/pdf/10.1200/JCO.19.02750>
19 - Brunt AM, Haviland JS, Wheatley DA, et al. Hypofractionated breast radiotherapy for 1 week versus 3 weeks (Fast-Forward): 5-year efficacy and late normal tissue effects results from a multicentre, no-inferiority, randomized, phase 3 trial. The Lancet. 2020;395(10237):1613-1626.
20 - Jagsi R, Griffith KA, Vicini F, et al. Toward improving patient’s experiences of acute toxicity from breast radiotherapy: insights from the analysis of patient-reported outcomes in a large multicenter cohort. J Clin Oncol. 2020. JCO2001703. doi: 10.1200/JCO.20.01703. Online ahead of print
21 - Vicini FA, Cecchini RS, White JR, et al. Long term primary results of accelerated partial breast irradiation after breast conserving surgery for early stage breast cancer: a randomized, phase 3, equivalence trial. The Lancet. 2019; 394(10215):2155-2164.
22 - Coles CE, Griffin CL, Kirby AM, et al. Partial breast radiotherapy after breast conservation surgery for patients with an early breast cancer (UK IMPORT LOW trial): 5-year results from a multicentre, randomized, controlled, phase 3, non-inferiority trial. Lancet.2017;390:1048-60.
23 - Meattini I, Marrazzo L, Saieva C, et al. Accelerated partial breast irradiation compared with whole breast irradiation for early breast cancer: long term results of the randomized phase III APBI-IMRT-Florence trial. J Clin Oncol.2020.https://ascopubs.org/doi/10.1200/JCO.20.00650?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed. Acessed on 04 october 2020.
24 - Vaidya JS, Bulsara M, Baum M, et al. Long term survival and local control outcomes from single dose targeted intraoperative radiotherapy during lumpectomy (TARGIT-IORT) for early breast cancer: TARGIT-A randomised clinical trial. BMJ. 2020;370:m2386
25 - Correa C, Harris EE, Leonardi MC, et al. Accelerated Partial Breast Irradiation: executive summary for the update of an ASTRO evidence-based consensus statement. Practical Radiat Oncol. 2017;7(2):73-79
26 - Polgar C, Limbergen EV, Potter R, et al. Patient selection for accelerated partial breast irradiation (APBI) after breast-conserving surgery: recommendations of the Groupe Européen de Curiethérapie – European Society for Therapeutic Radiology and Oncology (GEC-ESTRO) breast cancer working group based on clinical evidence. Radiother Oncol. 2010; 94(3):264-73
27 - Shah C, Vicini F, Shaitelman F, et al. The American Brachytherapy Society consensus statement for accelerated partial breast irradiation. Brachytherapy. 2018;17(1):154-170
28 - Haussmann J, Budach W, Corradini S, et al. No difference in overall survival and nonbreast cancer deaths after partial breast radiotherapy compared to whole breast radiotherapy – a meta-analysis of randomized trials. Cancers. 2020;12(8):2309
29 - Marta GN, Macedo CR, Carvalho HA, et al. Accelerated partial irradiation for breast cancer: systematic review and meta-analysis of 8653 women in eight randomized trials. Radiother Oncol.2015;114(1):42-9
30 - Poortmans PM, Collette L, Bartelink H, et al. The addition of a boost dose on the primary tumour bed after lumpectomy in breast conserving treatment for breast cancer. A summary of the results of EORTC 22881-10882 "boost versus no boost" trial. Cancer Radiotherapie. 2008; 12:565-570.
31 - Smith BD, Bellon JR, Blitzblau R, et al. Radiation therapy for the whole breast: executive summary of an American Society for Radiation Oncology (ASTRO) evidence-based guideline. Practical Radiat Oncol. 2018;8:145-152.
32 - Newhauser WD, Berrington de Gonzalez A, Schulte R, et al. A review of radiotherapy-induced late effects research after advanced technology treatments. Front Oncol. 2016;6:13.
33 - Jaoude JA, Kayali M, Azambuja E, et al. De-intensifying radiation therapy in HER-2 positive breast cancer: to boost or not to boost. Int J Radiat Oncol Biol Phys. 2020;S0360-3016(20)34197-3.
34 - von Minckwitz G, Procter M, de Azambuja E, Zardavas D, Benyunes M, Viale G, et al. Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer. N Engl J Med. 13 de julho de 2017;377(2):122–31.
35 - Six-Year APHINITY Trial Update - The ASCO Post [Internet]. [citado 12 de setembro de 2020]. Disponível em: https://ascopost.com/issues/january-25-2020/six-year-aphinity-trial-update/
36 - Tolaney SM, Barry WT, Dang CT, Yardley DA, Moy B, Marcom PK, et al. Adjuvant Paclitaxel and Trastuzumab for Node-Negative, HER2-Positive Breast Cancer. N Engl J Med. 8 de janeiro de 2015;372(2):134–41.
37 - Tolaney SM, Guo H, Pernas S, Barry WT, Dillon DA, Ritterhouse L, et al. Seven-Year Follow-Up Analysis of Adjuvant Paclitaxel and Trastuzumab Trial for Node-Negative, Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer. J Clin Oncol. 1o de agosto de 2019;37(22):1868–75.
38 - Tolaney SM, Trippa L, Barry W, et al. TBCRC 033: A randomized phase II study of adjuvant trastuzumab emtansine vs paclitaxel in combination with trastuzumab for stage I HER2-positive breast cancer (ATEMPT). 2019 San Antonio Breast Cancer Symposium. Abstract GS1-05. Presented December 11, 2019.
39 - Trastuzumab after Adjuvant Chemotherapy in HER2-Positive Breast Cancer | NEJM [Internet]. [citado 12 de setembro de 2020]. Disponível em: https://www.nejm.org/doi/full/10.1056/nejmoa052306
40 - 11 years’ follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial [Internet]. [citado 12 de setembro de 2020]. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5465633/
41 - 6 versus 12 months of adjuvant trastuzumab for HER2-positive early breast cancer (PERSEPHONE): 4-year disease-free survival results of a randomised phase 3 non-inferiority trial - The Lancet [Internet]. [citado 12 de setembro de 2020]. Disponível em: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(19)30650-6/fulltext
42 - Effect of Adjuvant Trastuzumab for a Duration of 9 Weeks vs 1 Year With Concomitant Chemotherapy for Early Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer: The SOLD Randomized Clinical Trial | Breast Cancer | JAMA Oncology | JAMA Network [Internet]. [citado 12 de setembro de 2020]. Disponível em: https://jamanetwork.com/journals/jamaoncology/fullarticle/2682589
43 - Nine weeks versus 1 year adjuvant trastuzumab in combination with chemotherapy: final results of the phase III randomized Short-HER study‡ - PubMed [Internet]. [citado 12 de setembro de 2020]. Disponível em: https://pubmed.ncbi.nlm.nih.gov/30219886/
44 - Evaluation of 1-Year vs Shorter Durations of Adjuvant Trastuzumab Among Patients With Early Breast Cancer: An Individual Participant Data and Trial-Level Meta-analysis | Breast Cancer | JAMA Network Open | JAMA Network [Internet]. [citado 12 de setembro de 2020]. Disponível em: https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2769686
45 - Cortazar P, Zhang L, Untch M, Mehta K, Costantino JP, Wolmark N, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. The Lancet. julho de 2014;384(9938):164–72.
46 - Pathologic Complete Response after Neoadjuvant Chemotherapy and Impact on Breast Cancer Recurrence and Survival: A Comprehensive Meta-analysis - PubMed [Internet]. [citado 12 de setembro de 2020]. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32046998/
47 - Martin M, Holmes FA, Ejlertsen B, Delaloge S, Moy B, Iwata H, et al. Neratinib after trastuzumab-based adjuvant therapy in HER2-positive breast cancer (ExteNET): 5-year analysis of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. dezembro de 2017;18(12):1688–700.
48 - von Minckwitz G, Huang C-S, Mano MS, Loibl S, Mamounas EP, Untch M, et al. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med. 14 de fevereiro de 2019;380(7):617–28.
49 - https://clinicaltrials.gov/ct2/show/NCT04266249">CompassHER2-pCR: Decreasing Chemotherapy for Breast Cancer Patients After Pre-surgery Chemo and Targeted Therapy - Full Text View - ClinicalTrials.gov [Internet]. [citado 13 de setembro de 2020]. Disponível em: https://clinicaltrials.gov/ct2/show/NCT04266249
50 - File D, Curigliano G, Carey LA. Escalating and De-escalating Therapy for Early-Stage HER2-Positive Breast Cancer. Am Soc Clin Oncol Educ Book. maio de 2020;(40):3–13.
51 - Fernandez-Martinez A, Tanioka M, Fan C, Parker JS, Hoadley KA, Krop I, et al. Predictive and prognostic value of B-cell gene-expression signatures and B-cell receptor (BCR) repertoire in HER2+ breast cancer: A correlative analysis of the CALGB 40601 clinical trial (Alliance). Ann Oncol. outubro de 2019;30:v55.
52 - Prospective Biomarker Analysis of the Randomized CHER-LOB Study Evaluating the Dual Anti-HER2 Treatment With Trastuzumab and Lapatinib Plus Chemotherapy as Neoadjuvant Therapy for HER2-Positive Breast Cancer - PubMed [Internet]. [citado 13 de setembro de 2020]. Disponível em: https://pubmed.ncbi.nlm.nih.gov/26245675/
53 - I-SPY 2 TRIAL: Neoadjuvant and Personalized Adaptive Novel Agents to Treat Breast Cancer - Full Text View - ClinicalTrials.gov [Internet]. [citado 13 de setembro de 2020]. Disponível em: https://clinicaltrials.gov/ct2/show/NCT01042379.







