O anti PD-1 cemiplimabe (Libtayo®, Sanofi) demonstrou benefício clínico significativo no tratamento do carcinoma espinocelular (CEC) em pacientes com doença avançada ou metastática1,2. Agora, artigo de Rischin, D et al. no Journal for Immunotherapy of Cancer3 traz nova análise avaliando a dose fixa de 350 mg por via intravenosa (IV) a cada 3 semanas (Q3W) em pacientes metastáticos, além de dados atualizados com a dose de 3 mg/kg IV a cada 2 semanas (Q2W). Os resultados mostram que cemiplimabe na dose fixa de 350 mg Q3W produziu atividade antitumoral robusta, projetando-se como um esquema mais conveniente para os pacientes e com menos risco de erro de dosagem ou desperdício de medicamento. Os dados de acompanhamento de longo prazo também demonstram a duração e a profundidade da resposta com cemiplimabe com base no peso do paciente, corroborando a atual base de evidências.
O anti PD-1 cemiplimabe (Libtayo®, Sanofi) demonstrou benefício clínico significativo no tratamento do carcinoma espinocelular (CEC) em pacientes com doença avançada ou metastática1,2. Agora, artigo de Rischin, D et al. no Journal for Immunotherapy of Cancer3 traz nova análise avaliando a dose fixa de 350 mg por via intravenosa (IV) a cada 3 semanas (Q3W) em pacientes metastáticos, além de dados atualizados com a dose de 3 mg/kg IV a cada 2 semanas (Q2W). Os resultados mostram que cemiplimabe na dose fixa de 350 mg Q3W produziu atividade antitumoral robusta, projetando-se como um esquema mais conveniente para os pacientes e com menos risco de erro de dosagem ou desperdício de medicamento. Os dados de acompanhamento de longo prazo também demonstram a duração e a profundidade da resposta com cemiplimabe com base no peso do paciente, corroborando a atual base de evidências.
Rischin, D et al. descrevem que cemiplimab demonstrou atividade antitumoral em coortes de expansão de estudo de Fase I (NCT02383212) envolvendo pacientes com CEC avançado e alcançou taxa de resposta objetiva (ORR) por revisão central independente (RCI) de 47,5% na análise primária do estudo pivotal de Fase II (NCT02760498) com dosagem baseada no peso do paciente (Grupo 1). A partir dessas evidências, cemiplimab-rwlc tornou-se a primeira terapia aprovada pela agência norte-americana Food and Drug Administration para o tratamento de CEC avançado, com a dose de 3 mg/kg IV a cada 2 semanas (Q2W), em pacientes não candidatos à cirurgia ou radioterapia4. Em julho de 2019, a agência europeia aprovou a comercialização de cemiplimabe no regime de dose fixa, com 350 mg a cada 3 semanas (Q3W) por via intravenosa5.
|
|
Nesta análise, os autores apresentam resultados dos dois esquemas. No total, 56 pacientes inscritos no estudo pivotal de Fase II foram tratados com cemiplimabe 350 mg Q3W (Grupo 3) de julho de 2017 a março de 2018 e 59 pacientes receberam a dose de 3mg / kg Q2W (Grupo 1), de março de 2016 até janeiro de 2017. O objetivo principal para cada grupo foi a taxa de resposta objetiva (ORR, da sigla em inglês) por revisão central independente. Endpoints secundários incluíram ORR por revisão do investigador (INV), duração da resposta (DOR) por RCI e INV, além de dados de segurança e tolerabilidade.
Na análise por revisão central independente, a taxa de resposta objetiva foi de 41,1% (IC 95%, 28,1% a 55,0%) no Grupo 3, em um acompanhamento pela mediana de 8,1 meses (variação de 0,6 a 14,1). No Grupo 1, a ORR alcançou 49,2% (IC 95%, 35,9% a 62,5%) em um follow-up pela mediana de 16,5 meses (variação de 1,1 a 26,6). A ORR combinada nos dois grupos foi de 45,2% (IC 95%, 35,9% a 54,8 %).
Na análise dos investigadores, a ORR foi de 51,8% (IC 95%, 38,0% a 65,3%) no Grupo 3 e de 49,2% (IC 95%, 35,9% a 62,5%) no Grupo 1, enquanto a ORR combinada foi de 50,4% (IC de 95%, 41,0% a 59,9%) nos dois grupos.
Em relação à duração de resposta, a revisão central independente estimou que a DOR em 8 meses foi de 95,0% (IC de 95%, 69,5% a 99,3%) em pacientes do Grupo 3; em 12 meses foi de 88,9% (IC de 95%, 69,3% a 96,3%) entre pacientes do grupo 1. Nos dois grupos os pacientes experimentaram redução significativa no diâmetro das lesões. Rischin, D et al também reportam quo os pacientes do Grupo 3 receberam em média 11,5 doses (variação de 1 a 20) e foram expostos ao tratamento com cemiplimabe pela mediana de 34,3 semanas (variação de 2,6 a 60,4). Pacientes do Grupo 1 receberam em média 31,0 doses (variação de 1 a 48) e foram expostos ao tratamento pela mediana de 65,0 semanas (variação de 2,0 a 96,1).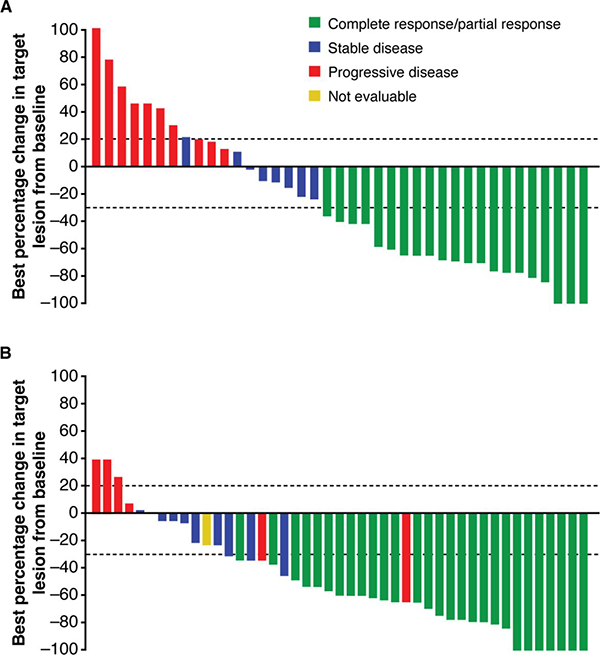
A taxa de controle da doença por RCI foi de 64,3% (IC de 95%, 50,4% a 76,6%) no Grupo 3, 71,2% (IC de 95%, 57,9% a 82,2%) no Grupo 1 e de 67,8% (IC de 95%, 58,5 % a 76,2%) na combinação dos dois grupos. A taxa de controle de doença durável por RCI foi de 57,1% (IC de 95%, 43,2% a 70,3%) no Grupo 3, atingiu 61,0% (IC de 95%, 47,4% a 73,5%) no Grupo 1 e 59,1% (IC de 95%, 49,6% a 68,2%) nos dois grupos combinados. Os autores descrevem que o tempo médio de resposta na análise da RCI foi de 2,1 meses (variação de 2,0 a 8,3) para o Grupo 3, de 1,9 (variação de 1,7 a 9,1) meses para o Grupo 1 e 2,1 meses (variação de 1,7 a 9,1) na combinação dos dois grupos.
No momento do corte de dados, os autores descrevem que a mediana de SLP estimada por Kaplan-Meier por revisão central independente foi de 10,4 meses (IC de 95%, de 3,6 meses a não
|
Dados de mundo real6 Um programa instituído pelo governo francês permitiu o acesso a cemiplimabe para o tratamento de pacientes com carcinoma espinocelular (CEC) localmente avançado ou metastático. Os resultados deste estudo de mundo real foram reportados no ESMO Virtual Congress 2020. Nesta análise retrospectiva, que considerou a participação de 45 centros franceses, o principal endpoint foi a melhor taxa de resposta; endpoints secundários incluíram sobrevida livre de progressão (SLP), sobrevida global (SG), duração de resposta (DOR) e dados de segurança. A dose de cemiplimabe considerou 3 mg / kg / 2 semanas. No corte de dados (05/05/20), um total de 247 pacientes foram inscritos e dados de prontuários de 193 pacientes foram considerados na análise, sendo 141 homens, 52 mulheres, com idade média de 77 anos. Metade dos pacientes recebeu cemiplimabe como 1ª linha de tratamento; 68% com CEC primário de cabeça e pescoço; 37% com doença localizada; 36% com doença regional e 27% com metástases à distância. Dessa população de mundo real, 26% eram pacientes imunocomprometidos e 72% tinham bom performance status (PS 0/1). Os pacientes receberam em média 10 infusões de cemiplimabe (0-35). Os dados reportados no ESMO mostram que entre 188 pacientes que receberam mais de 1 infusão, a melhor taxa de resposta foi de 50% (IC95% 43-57%, 40 com resposta completa e 54 com resposta parcial); a taxa de controle da doença foi de 60%. Em um acompanhamento médio e 12 meses (1-20), a mediana de SLP foi de 11 meses e as medianas de SG e DOR não foram alcançadas; 65% dos pacientes estavam vivos 1 ano após o início do tratamento com cemiplimabe (CI95%, 57-73%). Eventos adversos relacionados ao tratamento (TRAE) foram relatados em 49 (26%) pacientes, sendo os mais frequentes (> 2%) fadiga, hipotireoidismo e colestase. Um total de 18 (9%) pacientes experimentaram eventos adversos de grau 3 e 4. Não houve mortes relacionadas ao tratamento e apenas 5% dos pacientes interromperam o tratamento por toxicidade (colestase e / ou citólise (3 casos), anorexia, fadiga, anemia, insuficiência renal, poliartrite, síndrome de DRESS, colite). “Estes resultados sugerem fortemente que cemiplimabe, nos primeiros pacientes franceses tratados em ambiente de vida real, forneceu benefício semelhante ao observado em ensaios clínicos”, concluíram os autores. |
avaliável) para o Grupo 3, com base na taxa de eventos de 44,6%. No Grupo 1, a mediana de SLP foi estimada em 18,4 meses (IC de 95%, variação de 6,8-não avaliável) com base na taxa de eventos de 47,5%, enquanto a estimativa de SLP combinada foi de 18,4 meses, refletindo a taxa de eventos de 46,1% nos dois grupos. A estimativa de SLP em 12 meses foi de 47,4% para o Grupo 3, de 52,9% para o Grupo 1 e de 51,2% na análise combinada dos dois grupos.
A publicação no Journal for Immunotherapy of Cancer reporta, ainda, a estimativa de sobrevida global (SG), indicando que a Kaplan-Meier de SG em 12 meses foi de 76,1% (IC de 95%, 56,9% a 87,6%) para o Grupo 3, de 81,3% (IC de 95%, 68,7% a 89,2%) para o Grupo 1 e 80,7% (95 % CI, 71,9% a 87,1%) para a combinação dos dois grupos.
As medianas de SG e SLP não foram alcançadas em nenhum dos braços de tratamento.
O perfil de segurança foi consistente com dados já conhecidos. No geral, os eventos adversos mais comuns foram fadiga (27,0%) e diarreia (23,5%), independentemente do grupo de intervenção. Nos dois grupos, 113 (98,3%) pacientes experimentaram pelo menos um evento adverso (EA) de qualquer grau relacionado ao tratamento. Os EAs mais comuns no Grupo 3, Grupo 1 e na combinação dos dois grupos foram fadiga (28,6%, 25,4% e 27,0%, respectivamente), diarreia (17,9%, 28,8% e 23,5%, respectivamente) e náusea (17,9%, 23,7% e 20,9%, respectivamente). EAs de grau ≥3 relacionados ao tratamento foram relatados em 45,2% dos pacientes do estudo.
“O regime de dose fixa do Grupo 3 oferece vantagens como um esquema mais conveniente para os pacientes e com menos risco de erro de dosagem ou desperdício de medicamento”, destacam os autores, lembrando que cemiplimabe 350 mg Q3W por via intravenosa é a dose comercialmente aprovada. Dados clínicos adicionais sobre o regime de dose fixa do anti PD-1 cemiplimabe no CEC avançado são aguardados de uma coorte confirmatória (Grupo 6) deste estudo.
Análise de biomarcador
Um total de 79 pacientes tinha amostras de tumor pré-tratamento para análise da possível associação entre a carga mutacional ou tumor mutational burden (TMB) e a atividade clínica de cemiplimabe. A mediana de TMB foi de 61,4 e 53,2 mutações por megabase entre os pacientes que responderam ao tratamento no Grupo 3 e no Grupo 1, respectivamente, e foi de 13,7 e 19,4 mutações por megabase entre os pacientes que não responderam nos Grupos 3 e 1, respectivamente. Em síntese, a mediana de TMB mais alta foi observada entre os pacientes que responderam. “No entanto, TMB alto entre alguns não respondedores e TMB baixo entre alguns que responderam impedem que essa ferramenta seja usada para a seleção de pacientes”, alertam os autores, indicando que futuros estudos podem avançar na definição de potenciais biomarcadores e características genômicas associados ao benefício clínico entre pacientes com CEC avançado tratados com cemiplimabe.
Estimativas do Instituto Nacional do Câncer (INCA, 2018) apontam 165 mil novos casos de câncer de pele não melanoma a cada ano6. O carcinoma espinocelular corresponde a 20% de todos os tumores cutâneos não melanoma.
Os estudos com cemiplimabe receberam financiamento da Sanofi e da Regeneron Pharmaceuticals, em um acordo global de colaboração.
Referências:
- FDA approves cemiplimab-rwlc for metastatic or locally advanced cutaneous squamous cell carcinoma. Disponível em https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-cemiplimab-rwlc-metastatic-or-locally-advanced-cutaneous-squamous-cell-carcinoma
- Migden, M. R., Khushalani, N. I., Chang, A. L. S., Lewis, K. D., Schmults, C. D., Hernandez-Aya, L., … Rischin, D. (2020). Cemiplimab in locally advanced cutaneous squamous cell carcinoma: results from an open-label, phase 2, single-arm trial. The Lancet Oncology. doi:10.1016/s1470-2045(19)30728-4
- Migden, M. R., Rischin, D., Schmults, C. D., Guminski, A., Hauschild, A., Lewis, K. D., … Fury, M. G. (2018). PD-1 Blockade with Cemiplimab in Advanced Cutaneous Squamous-Cell Carcinoma. New England Journal of Medicine, 379(4), 341–351. doi:10.1056/nejmoa1805131
- Rischin D, Migden MR, Lim AM, et alPhase 2 study of cemiplimab in patients with metastatic cutaneous squamous cell carcinoma: primary analysis of fixed-dosing, long-term outcome of weight-based dosingJournal for ImmunoTherapy of Cancer 2020;8:e000775. doi: 10.1136/jitc-2020-000775
- European Medicines Agency. LIBTAYO® EPAR, 2019. Available:https://www.ema.europa.eu/en/medicines/human/EPAR/libtayo
- 1086P Cemiplimab for advanced cutaneous squamous cell carcinoma: Real life experience; Hober et al








