Keith W. Pratz (foto), médico da Divisão de Hematologia e Oncologia do Abramson Cancer Center, da Universidade da Pennsylvania, apresentou no ASH 2022 nova análise do estudo de fase 3 VIALE-a, avaliando venetoclax (Ven) em combinação com azacitidina (Aza) no tratamento de pacientes com Leucemia Mieloide Aguda (LMA) recém-diagnosticados inelegíveis para quimioterapia intensiva, agora após a ocorrência de 100% dos eventos de sobrevida global pré-planejados no braço de intervenção. A análise do VIALE-a com 2 anos de acompanhamento confirma o benefício de sobrevida a longo prazo para pacientes tratados com Ven+Aza, sem novos achados de segurança.
Keith W. Pratz (foto), médico da Divisão de Hematologia e Oncologia do Abramson Cancer Center, da Universidade da Pennsylvania, apresentou no ASH 2022 nova análise do estudo de fase 3 VIALE-a, avaliando venetoclax (Ven) em combinação com azacitidina (Aza) no tratamento de pacientes com Leucemia Mieloide Aguda (LMA) recém-diagnosticados inelegíveis para quimioterapia intensiva, agora após a ocorrência de 100% dos eventos de sobrevida global pré-planejados no braço de intervenção. A análise do VIALE-a com 2 anos de acompanhamento confirma o benefício de sobrevida a longo prazo para pacientes tratados com Ven+Aza, sem novos achados de segurança.
Venetoclax (Ven), um inibidor oral altamente seletivo de BCL-2, mostrou resultados positivos em combinação com Aza nesta população (DiNardo et. al. NEJM, 2020). Em um acompanhamento médio de 20,5 (intervalo, <0,1-30,7) meses (mês), com 270 eventos de morte (75% SG) a sobrevida global (SG) mediana em janeiro de 2020 foi de 14,7 meses para o grupo Ven+Aza e de 9,6 meses no grupo Pbo+Aza (razão de risco [HR], 0,66; intervalo de confiança [IC] de 95%, 0,52 a 0,85; P<0,001). A remissão completa (CR) foi maior com Ven+Aza do que com Pbo+Aza (36,7% vs 17,9%; P<0,001), assim como a remissão completa + remissão completa com recuperação hematológica incompleta (CR+CRi) (66,4% vs 28,3%; P<0,001) (DiNardo et. al. NEJM, 2020).
No ASH 2022, Pratz et al. apresentaram dados da análise final de sobrevida global, após a ocorrência de 100% dos eventos pré-planejados (360 eventos de sobrevida; dados de 1º de dezembro de 2021), com 2 anos de acompanhamento adicional.
Foram considerados 431 pacientes com LMA, sem tratamento prévio e inelegíveis para terapia intensiva.
Os pacientes elegíveis foram randomizados 2:1 para Aza mais Ven (286 pacientes) ou Placebo (145 pacientes). Todos os pacientes receberam uma dose padrão de Aza (75 mg/m2 por via subcutânea ou intravenosa nos dias 1 a 7 a cada ciclo de 28 dias). Ven 400 mg após 3 dias para atingir a dose alvo no Ciclo 1 ou Pbo correspondente foi administrado por via oral, uma vez ao dia, em ciclos de 28 dias.
Resultados
Os participantes tinham mediana de 76 anos em ambos os grupos, aproximadamente 60% do sexo masculino e 76% caucasianos. Anormalidades moleculares de interesse incluíram FLT-3, observada em 14,1% dos pacientes recebendo VEN+AZA, IDH1/2, observada em 24,9% dos pacientes, TP53, observada em 23,3% dos pacientes e NPM1, observada em 16,6% dos pacientes.
Em um seguimento mediano de 43,2 meses, a sobrevida global mediana foi de 14,7 meses (95% CI, 12,1 a 18,7) no grupo Ven+Aza e 9,6 meses (95% CI, 7,4 a 12,7) no grupo Pbo+Aza (HR, 0,58; IC 95%, 0,47 a 0,72; nominal P<0,001), mantendo o benefício de sobrevida desde análise interina.
Neste corte de dados, 49 pacientes permaneceram no estudo (48 no grupo Ven+Aza e 1 no grupo Pbo+Aza). Em pacientes com doença residual mensurável (DRM) <10-3 que atingiram CR+CRi, a SG mediana foi alcançada em 34,2 meses (95% CI, 27,7-44,0) no grupo Ven+Aza (N=69) e 25,0 meses (95% CI, 7,0-39,8) no grupo Pbo+Aza (N=11). Em pacientes CR + CRi com MRD > 10-3, a SG mediana foi de 18,7 meses (95% CI, 12,9-23,5) no grupo Ven+Aza (N=96) e 15,1 meses (95% CI, 7,4, 26,1) no grupo Pbo+Aza (N=24). Para pacientes no subgrupo com mutação IDH1/2, a SG mediana foi alcançada na análise final, em 19,9 meses (95% CI, 12,2-27,7) no grupo Ven+Aza e 6,2 meses (95% CI, 2,3-12,7) no grupo Pbo+Aza (HR, 0,314; IC 95%, 0,189 a 0,522; P<0,001) (Figura 2).
Os perfis de segurança foram comparáveis entre Ven+Aza e Pbo+Aza. Os principais eventos adversos emergentes do tratamento de qualquer grau ocorrendo em ≥20% dos pacientes incluíram náusea (44,5% no grupo Ven+Aza versus 36,8% no grupo Pbo+Aza), diarreia (45,2% versus 34%) e constipação (43,8% vs 39,6%). EAs de grau 3 ou superior (Ven+Aza vs Pbo+Aza) ocorrendo em ≥10% dos pacientes incluíram trombocitopenia (45,9% vs 39,6%), neutropenia (42,8% vs 28,5%) e neutropenia febril (42,8% vs 18,8%). Eventos adversos graves ocorreram em 85,1% dos pacientes no grupo Ven+Aza e 77,1% no grupo Pbo+Aza.
“O acompanhamento de longo prazo do VIALE-a demonstra benefício de sobrevida global sustentado com Ven+Aza em pacientes com LMA inelegíveis para quimioterapia intensiva em comparação com Pbo+Aza em todos os subgrupos. Notavelmente, a SG mediana para pacientes com MRD <10-3 que atingiram CR+CRi foi de 34,2 meses, e a SG mediana para pacientes com mutações IDH1/2 tratados com Ven+Aza foi de 19,9 meses. A análise de acompanhamento de 2 anos do VIALE-a confirma o benefício de sobrevida a longo prazo para pacientes tratados com Ven+Aza, sem novos achados de segurança”, conclui a análise.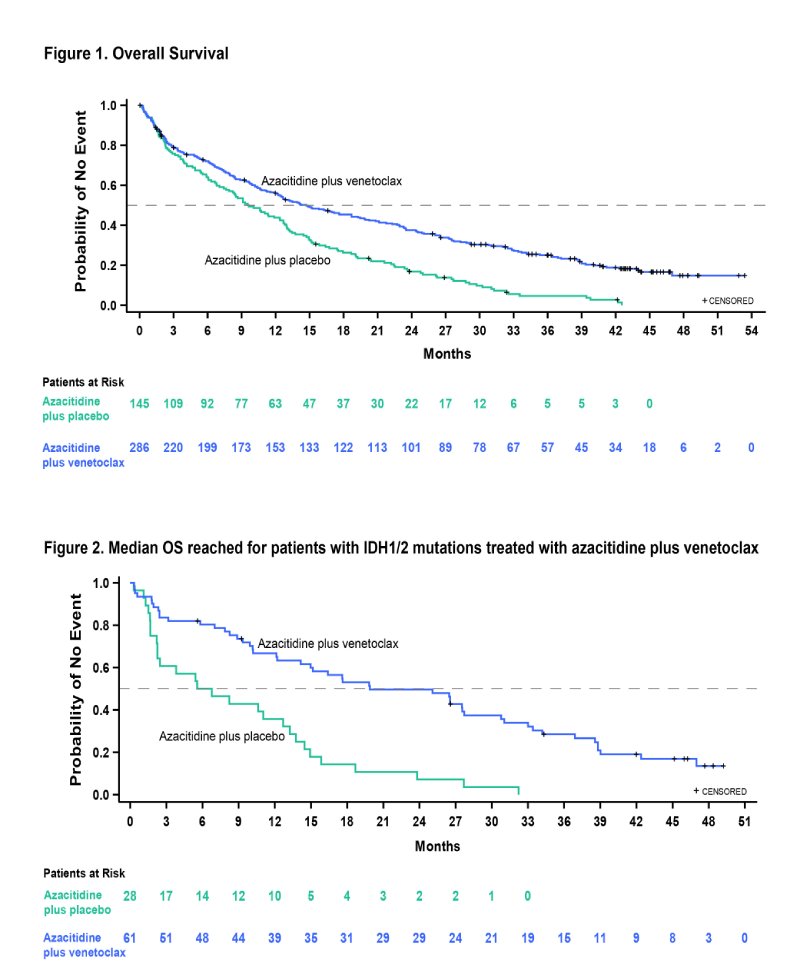
Referência: 219 Long-Term Follow-up of the Phase 3 Viale-a Clinical Trial of Venetoclax Plus Azacitidine for Patients with Untreated Acute Myeloid Leukemia Ineligible for Intensive Chemotherapy
Program: Oral and Poster Abstracts
Type: Oral Session: 615.
Saturday, December 10, 2022: 2:30 PM
Keith W. Pratz, MD et al