Em mais um tópico da coluna ‘Drops de Genômica’, o oncologista André Murad (foto) discute se é correto afirmar que as mutações sinônimas são sempre silenciosas ou “benignas”. Confira.
Em mais um tópico da coluna ‘Drops de Genômica’, o oncologista André Murad (foto) discute se é correto afirmar que as mutações sinônimas são sempre silenciosas ou “benignas”. Confira.
Por André Marcio Murad*
As mutações sinônimas são aquelas em que a mudança em um par de bases nucleotídicas de DNA que altera o códon correspondente codifica o mesmo aminoácido, portanto, não causando mudanças estruturais na proteína produzida. Ou seja, uma alteração na sequência de DNA de um códon não altera o resíduo do aminoácido correspondente na proteína codificada porque cada resíduo pode ser codificado por vários códons. Isso é chamado de Hipótese de Wobble. Até agora, essas mudanças sinônimas no DNA eram consideradas mutações “silenciosas”, pois não afetariam a estrutura ou a função da proteína resultante.
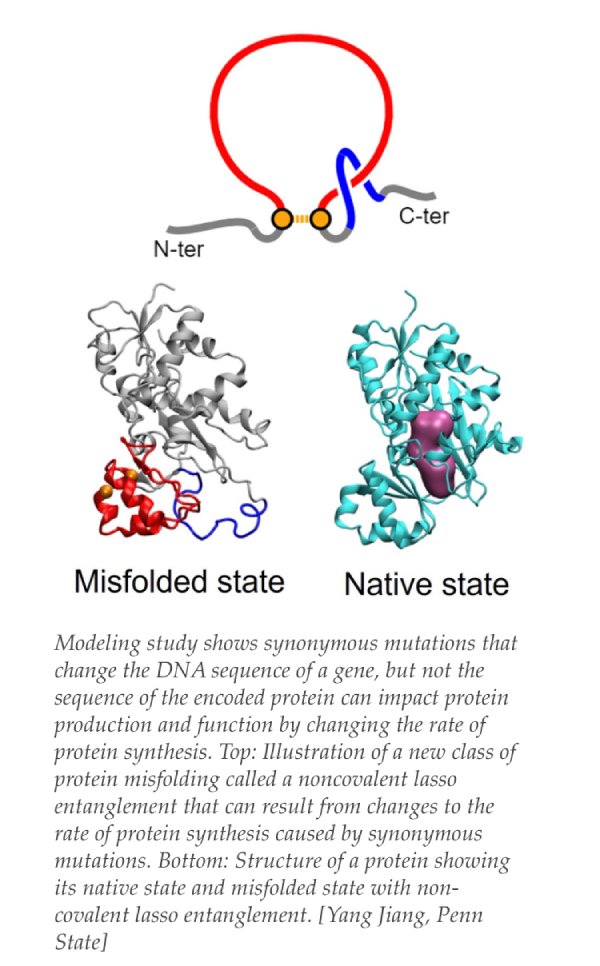
Entretanto, mais recentemente, pesquisadores da Universidade Estadual da Pensilvânia conduziram estudos computacionais e experimentais para refutar essa premissa. Mutações, mesmo que “silenciosas”, ainda podem afetar a síntese e a função das proteínas. Mudanças genéticas que alteram a velocidade da síntese de proteínas sem alterar a sequência de aminoácidos na proteína podem dobrar a proteína de maneiras anormais para alterar sua atividade. As descobertas destacam a importância da taxa de síntese de proteínas, além da sequência, na determinação da estrutura e da função proteica.
Os resultados desse estudo fornecem uma explicação de como a cinética também pode controlar a estrutura e a função das proteínas. Isso tem implicações para qualquer campo que envolva a síntese de proteínas. O dobramento incorreto de proteínas, função que ocorre principalmente na organela intracelular do Complexo de Golgi, também contribui para algumas doenças humanas, incluindo o câncer. Portanto, o estudo indica que pode existir inclusive uma classe de novos alvos para o desenvolvimento de drogas futuras.
Usando modelagem multiescala de três enzimas de Escherichia coli (tipo III cloranfenicol acetiltransferase, d-alanina-d-alanina ligase B e dihidrofolato redutase), os pesquisadores mediram as mudanças na atividade específica devido a mutações sinônimas.
Há mais de duas décadas, foi demonstrado que mutações sinônimas poderiam reduzir a atividade das proteínas, mas ainda não se sabia exatamente as alterações moleculares responsáveis por essa mudança.
Por uma variedade de razões, alguns códons são traduzidos em velocidades diferentes pelo ribossomo. Para três enzimas diferentes – proteínas especializadas que catalisam reações bioquímicas – o estudo simulou uma versão do mRNA composta de códons de tradução rápida e uma versão composta de códons de tradução lenta e, em seguida, modelou-se a produção da proteína nascente, como ela é dobrada pós-tradução e, finalmente, sua atividade.
Para isso, os autores examinaram as estruturas de proteínas previstas e as vias de dobramento de seus modelos para identificar alterações moleculares que poderiam ter levado às mudanças na atividade. Foi identificada assim uma nova classe de dobramento incorreto de proteínas, denominada “emaranhamento de laço não covalente”. Essencialmente, uma porção da proteína forma um loop fechado e uma extremidade da proteína passa incorretamente pelo loop e fica presa por longos períodos de tempo. Tal dobramento incorreto pode reduzir a atividade enzimática ocorrendo próximo ao sítio ativo da enzima ou evitando o reconhecimento por proteínas chaperonas que normalmente identificam e redobram ou removem proteínas mal dobradas.