A Agência Nacional de Vigilância Sanitária (ANVISA) aprovou o conjugado de anticorpo-medicamento (ADC) trastuzumabe deruxtecana (Enhertu®, Daiichi Sankyo, AstraZeneca), na dose de 6,4 mg/kg a cada três semanas, a partir da segunda linha de tratamento de pacientes com câncer gástrico e/ou de junção gastroesofágica metastático ou localmente avançado HER2+, previamente tratados com trastuzumabe. Publicada no Diário Oficial da União (DOU n° 210)1 dia 06 de novembro, a decisão foi baseada nos estudos DESTINY-Gastric01 e DESTINY-Gastric021-3.
Em junho de 2020, Shitara K. et al reportaram na New England Journal of Medicine (NEJM)2 os resultados do estudo aberto, randomizado, de Fase 2 DESTINY-Gastric01, que avaliou trastuzumabe deruxtecana (T-DXd) em comparação com quimioterapia em pacientes asiáticos (Japão e Coréia do Sul) com adenocarcinoma gástrico ou da junção gastroesofágica HER2+ confirmado por revisão central, que progrediram a pelo menos duas terapias anteriores, incluindo trastuzumabe. Os pacientes foram randomizados (2:1) para trastuzumabe deruxtecana (6,4 mg/kg) a cada 3 semanas ou quimioterapia de escolha do investigador. O endpoint primário foi a taxa de resposta objetiva, avaliada por revisão central independente. Os desfechos secundários incluíram sobrevida global, duração da resposta, sobrevida livre de progressão, resposta confirmada (resposta persistente ≥4 semanas) e aspectos relacionados à segurança. Entre 187 pacientes incluídos no estudo, 125 receberam trastuzumabe deruxtecana e 62 foram tratados com quimioterapia (55 receberam irinotecano e 7 paclitaxel).
A resposta objetiva foi observada em 51% dos pacientes no grupo de trastuzumabe deruxtecana em comparação com 14% dos pacientes no grupo de quimioterapia (P <0,001).
“A sobrevida global, endpoint secundário do estudo, demonstrou sobrevida mediana de 12,5 meses no grupo experimental com T-DXd contra 8,4 meses no grupo controle, com hazard ratio (HR), 0,59; 95% CI, 0,39 a 0,88; P = 0,01). Considerando o prognóstico reservado desse grupo de pacientes, é um número que chama a atenção”, observa o oncologista Duilio Rocha Filho (CRM 8309-CE), chefe do Serviço de Oncologia Clínica do Hospital Universitário Walter Cantídio (UFC) e médico da Clínica Fujiday Oncologia D´Or, em Fortaleza (CE).
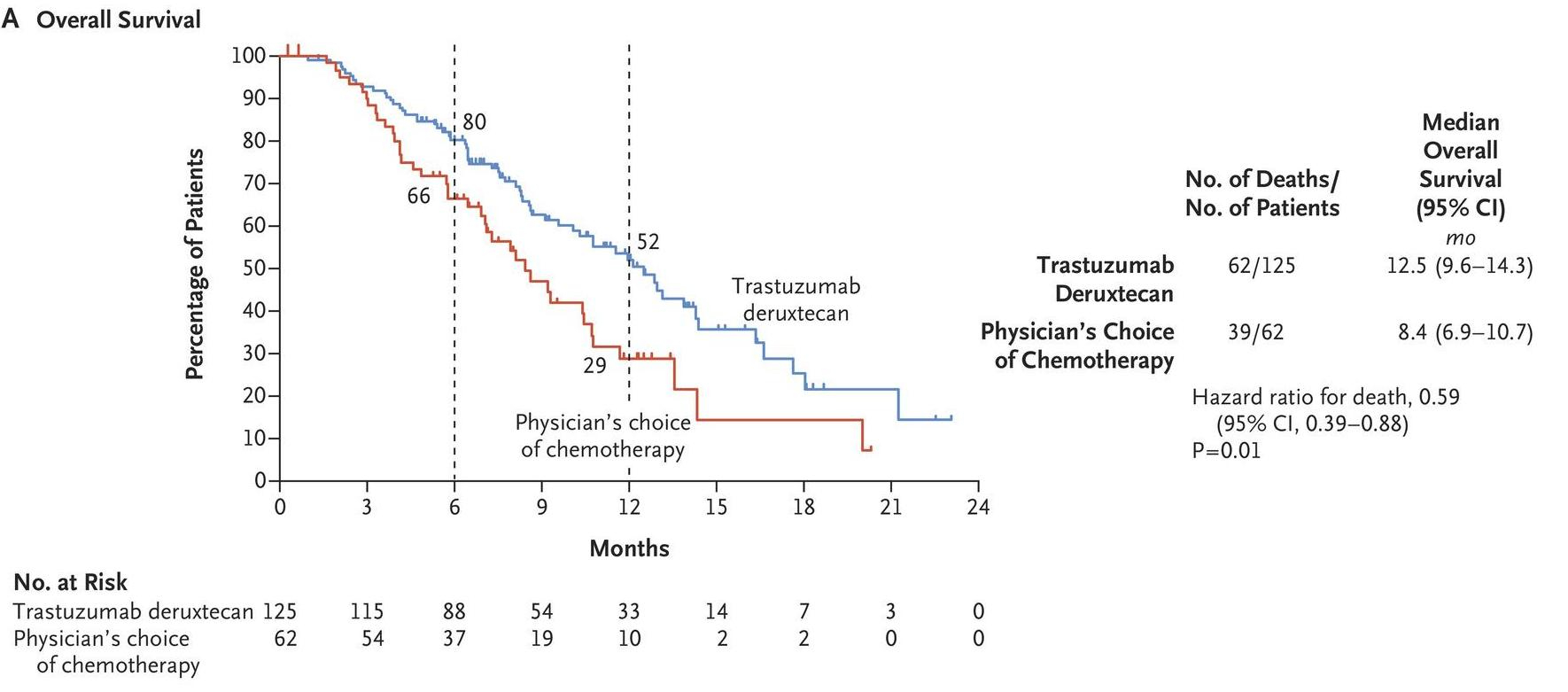
Fonte: Shitara K, et al. N Engl J Med 2020; 382:2419-2430
Os resultados demonstraram que a terapia com trastuzumabe deruxtecana levou a melhorias significativas na resposta e sobrevida global, em comparação com terapias padrão, entre pacientes com câncer gástrico e/ou de junção gastroesofágica HER2+. (NCT03329690)
Os eventos adversos de grau 3 ou superior mais comuns foram neutropenia (51% no grupo de trastuzumabe deruxtecana e 24% no grupo de quimioterapia), anemia (38% e
 |
A sobrevida global monstrou ganho 12,5 meses no grupo com T-DXd contra 8,4 meses no grupo controle2 |
23%, respectivamente) e leucopenia (21% e 11%). Um total de 12 pacientes apresentou doença pulmonar intersticial ou pneumonite relacionada a trastuzumabe deruxtecana (graus 1 ou 2 em 9 pacientes e graus 3 ou 4 em 3 pacientes). Uma morte relacionada ao medicamento (pneumonia) foi observada no grupo de trastuzumabe deruxtecana.
DESTINY-Gastric02
Em junho de 2023, Van Cutsem et al reportaram no Lancet Oncology3 os resultados da análise primária do estudo de Fase 2, de braço único, DESTINY-Gastric02, demonstrando resultados clinicamente significativos de T-DXd no tratamento de segunda linha do câncer gástrico avançado ou da junção gastroesofágica HER2+, agora em pacientes europeus e norte-americanos.
Os pacientes elegíveis tinham pelo menos 18 anos de idade, performance status ECOG 0 ou 1, câncer gástrico ou da junção gastroesofágica irressecável ou metastático documentado patologicamente, doença progressiva durante ou após a terapia de primeira linha com um regime contendo trastuzumabe, com pelo menos uma lesão mensurável (RECIST, versão 1.1) e doença HER2+ confirmada centralmente (IHC3+ ou IHC2+/ISH+, com biópsia pós-progressão ao trastuzumabe).
Os pacientes receberam 6,4 mg/kg de trastuzumabe deruxtecana via intravenosa a cada 3 semanas até a progressão da doença, retirada do consentimento, decisão do médico ou morte. O endpoint primário foi a taxa de resposta objetiva confirmada por revisão central independente. O endpoint primário e a segurança foram avaliados no conjunto de análise completo (ou seja, participantes que receberam pelo menos uma dose do medicamento do estudo).
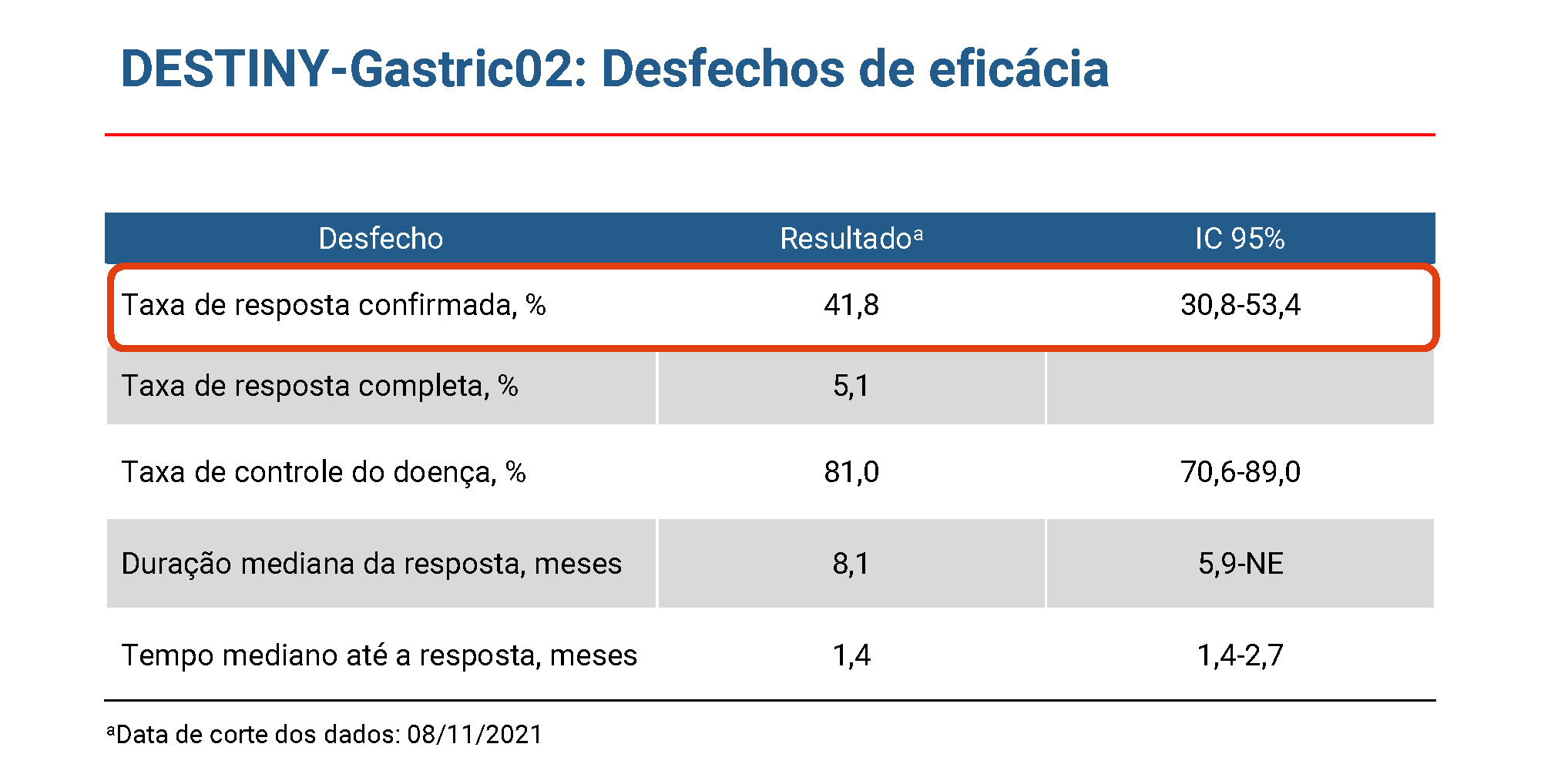
Fonte: Van Cutsem E, et al. Lancet Oncol 2023; 24:744-56
Os resultados publicados no Lancet Oncology correspondem à análise primária do estudo, com corte de dados em 9 de abril de 2021, e uma análise atualizada, com corte de dados em 8 de novembro de 2021.
Resultados
Entre 26 de novembro de 2019 e 2 de dezembro de 2020, foram incluídos 89 pacientes; 79 pacientes foram tratados com trastuzumabe deruxtecana (idade mediana de 60,7 anos [IQR 52·0–68·3], 57 [72%] eram homens, 22 [28%] eram mulheres, 69 [87%] eram brancos, quatro [5%] eram asiáticos, um [1%] era negro ou afro-americano, um [1%] era nativo do Havaí ou das ilhas do Pacífico, um tinha etnia ausente e três [4%] eram de outras etnias). “Vale ressaltar que 94% dos pacientes tinham pelo menos dois sítios de metástases, o que sugere ser um grupo com prognóstico mais difícil”, destaca Duilio.
Na análise primária (acompanhamento mediano de 5,9 meses [IQR 4,6–8,6 meses]), a resposta objetiva confirmada foi relatada em 30 (38% [95% CI 27,3–49,6]) dos 79 pacientes, incluindo três (4%) respostas completas e 27 (34%) respostas parciais, conforme avaliado por revisão central independente. A partir do corte de dados para a análise atualizada (acompanhamento mediano de 10,2 meses [IQR 5,6–12,9]), uma resposta objetiva confirmada foi relatada em 33 (42% [95% CI 30,8–53· 4]) de 79 pacientes, incluindo quatro (5%) respostas completas e 29 (37%) respostas parciais.
“Mais uma vez observamos a mediana de sobrevida global, endpoint secundário do estudo, além de 12 meses, e uma sobrevida livre de progressão também robusta quando comparado às terapias alternativas”, avalia Rocha Filho.

Fonte: Van Cutsem E, et al. Lancet Oncol 2023; 24:744-56
Os eventos adversos relacionados ao tratamento de grau 3 ou superior mais comuns foram anemia (11 [14%]), náusea (seis [8%]), neutropenia (seis [8%]) e leucopenia (cinco [6%]). Eventos adversos graves relacionados ao tratamento ocorreram em dez pacientes (13%). As mortes determinadas como associadas ao tratamento do estudo ocorreram em dois pacientes (3%) e foram devido doença pulmonar intersticial ou pneumonite.
“Os pesquisadores conseguiram construir uma história de sucesso. O HER2 foi o primeiro biomarcador validado em termos de seleção para tratamento sistêmico, e a primeira terapia-alvo incorporada no tratamento sistêmico dessa população. Curiosamente, várias outras moléculas foram desenvolvidas para câncer de mama HER2+, e foram testadas em estômago com resultados negativos”, observa Tulio Pfiffer (CRM 109137), oncologista do Hospital Sírio Libanês, em São Paulo (SP)5 e 6.
“Agora, felizmente nosso arsenal terapêutico está se ampliando, o tratamento sistêmico tem demonstrado melhores resultados e cada vez mais o tratamento personalizado guiado por biomarcadores ganha importância. Certamente, trastuzumabe deruxtecana é uma molécula muito bem-vinda no manejo dessa população de pacientes”, conclui.
O estudo está registrado em ClinicalTrials.gov, NCT04014075.
Sobre o câncer gástrico
Segundo as estimativas do Instituto Nacional do Câncer (INCA)4, sem considerar os tumores de pele não melanoma, o câncer de estômago ocupa a quinta posição entre os tipos de câncer mais frequentes.
O número estimado de casos novos de câncer de estômago para o Brasil, para cada ano do triênio de 2023 a 2025, é de 21.480 casos, correspondendo ao risco estimado de 9,94 casos por 100 mil habitantes, sendo 13.340 casos em homens e 8.140 casos em mulheres. Esses valores correspondem a um risco estimado de 12,63 casos novos a cada 100 mil homens e 7,36 a cada 100 mil mulheres.
A frequência da superexpressão de HER2 no câncer gástrico e gastroesofágico varia de 4,4% a 53,4%, com uma média de 17,9%.5
Assista sobre o mesmo tema:
Trastuzumabe deruxtecana na 2ª linha do câncer gástrico e/ou de junção gastroesofágica HER2+
Em vídeo, os oncologistas Duílio Rocha Filho (CRM 8309-CE) e Tulio Pfiffer (CRM 109137) analisam os resultados dos estudos DESTINY-Gastric01 e DESTINY-Gastric02, que levaram à aprovação pela Anvisa do conjugado de anticorpo-medicamento trastuzumabe deruxtecana (T-DXd) para o tratamento de segunda linha de pacientes com câncer gástrico e/ou de junção gastroesofágica HER2+. “Os resultados são bastante robustos em comparação com os tratamentos utilizados atualmente no tratamento de segunda linha dessa população pacientes, além de haver um racional biológico muito evidente que favorece T-DXd, o que deve torná-lo a estratégia preferencial”, avalia Duilio. Assista na TV Onconews.
Referências:
1 – DIÁRIO OFICIAL DA UNIÃO – Resolução n° 4.158, de 31 de outubro de 2023 - Publicado em: 06/11/2023 | Edição: 210 | Seção: 1 | Página: 88
2 - K. Shitara, Y.-J. Bang, S. Iwasa, N. Sugimoto, M.-H. Ryu, D. Sakai, H.-C. Chung, H. Kawakami, H. Yabusaki, J. Lee, K. Saito, Y. Kawaguchi, T. Kamio, A. Kojima, M. Sugihara, and K. Yamaguchi, for the DESTINY-Gastric01 Investigators*. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer. N Engl J Med 2020;382:2419-30. DOI: 10.1056/NEJMoa2004413. https://www.nejm.org/doi/full/10.1056/NEJMoa2004413
3 - Eric Van Cutsem, Maria di Bartolomeo, Elizabeth Smyth, Ian Chau, Haeseong Park, Salvatore Siena, Sara Lonardi, Zev A Wainberg, Jaffer Ajani, Joseph Chao, Yelena Janjigian, Amy Qin, Jasmeet Singh, Ferdous Barlaskar, Yoshinori Kawaguchi, Geoffrey Ku, Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study, The Lancet Oncology, 2023, ISSN 1470-2045, https://doi.org/10.1016/S1470-2045(23)00215-2.
4 - Estimativa 2023: incidência de câncer no Brasil / Instituto Nacional de Câncer. – Rio de Janeiro: INCA, 2022. 160 p.: ISBN 978-65-88517-09-3 (versão impressa) ISBN 978-65-88517-10-9 (versão eletrônica). https://www.gov.br/inca/pt-br/assuntos/cancer/numeros/estimativa/sintese-de-resultados-e-comentarios
5 - Abrahao-Machado LF, Scapulatempo-Neto C. HER2 testing in gastric cancer: An update. World J Gastroenterol. 2016 May 21;22(19):4619-25. doi: 10.3748/wjg.v22.i19.4619. PMID: 27217694; PMCID: PMC4870069. https://www.wjgnet.com/1007-9327/full/v22/i19/4619.htm
6 – Petrillo A, Smyth EC. Biomarkers for Precision Treatment in Gastric Cancer. Visc Med. 2020 Oct;36(5):364-372
Mini-bula
ENHERTU® (trastuzumabe deruxtecana). INDICAÇÕES: Câncer de mama: tratamento de pacientes adultos com câncer de mama HER2-positivo metastático ou não ressecável, que tenham recebido um regime de tratamento baseado em anti-HER2 no cenário metastático, ou no cenário neoadjuvante ou adjuvante, e que desenvolveram recorrência da doença durante ou dentro de 6 meses após a conclusão do tratamento. Tratamento de pacientes adultos com câncer de mama HER2 de baixa expressão (IHC 1+ ou IHC 2+/ISH-) metastático ou não ressecável que tenham recebido uma terapia sistêmica prévia no cenário metastático, ou que desenvolveram recorrência da doença durante ou dentro de 6 meses após a conclusão de quimioterapia adjuvante. Pacientes com câncer de mama HER2 de baixa expressão com receptor hormonal positivo (RH+) devem também ter recebido ou ser inelegíveis a terapia endócrina. Câncer de pulmão: tratamento de pacientes adultos com câncer de pulmão de não pequenas células (CPNPC) não ressecável ou metastático cujos tumores tenham mutações HER2 (ERBB2) ativas e que tenham recebido uma terapia sistêmica prévia. Câncer gástrico: tratamento de pacientes adultos com adenocarcinoma gástrico ou da junção gastroesofágica (JGE) localmente avançado ou metastático HER2-positivo que receberam regime anterior à base de trastuzumabe.
CONTRAINDICAÇÕES: hipersensibilidade ao trastuzumabe deruxtecana ou a qualquer dos componentes da formulação. CUIDADOS E ADVERTÊNCIAS: casos de doença pulmonar intersticial (DPI) e/ou pneumonite foram relatados com ENHERTU®. Os pacientes devem ser orientados a relatar imediatamente no caso de tosse, dispneia, febre e/ou qualquer novo sintoma ou piora de sintomas respiratórios, e devem ser monitorados para sinais ou sintomas de DPI / pneumonite. Casos de neutropenia, incluindo neutropenia febril foram relatados nos estudos clínicos de ENHERTU®. O hemograma completo deve ser monitorado antes do início do tratamento com ENHERTU® e antes de cada dose, conforme clinicamente indicado. Redução da fração de ejeção de ventrículo esquerdo (FEVE) é observada com terapias anti-HER2. A FEVE deve ser avaliada antes do início do tratamento com ENHERTU® e em intervalos regulares durante o tratamento, conforme clinicamente indicado. Categoria de risco na gravidez: D. A administração de ENHERTU® a gestantes não é recomendada e as pacientes devem ser informadas dos potenciais riscos ao feto antes de engravidarem. Mulheres que engravidarem devem imediatamente contatar seu médico. Caso uma mulher engravide durante o tratamento com ENHERTU®, ou em até sete meses após a última dose do tratamento, é recomendado monitoramento próximo. Lactação: não se sabe se ENHERTU® é excretado no leite materno humano. Como muitos fármacos são excretados no leite humano, e devido ao potencial de reações adversas graves em lactentes em aleitamento materno, as mulheres devem descontinuar a amamentação antes do início do tratamento com ENHERTU®. As mulheres podem iniciar o aleitamento sete meses após a última dose do tratamento.
INTERAÇÕES MEDICAMENTOSAS: a coadministração com ritonavir aumentou a exposição do trastuzumabe deruxtecana em 19% e do inibidor da topoisomerase I livre em 22%. Não é necessário ajuste de dose durante a administração concomitante de ENHERTU® com medicamentos inibidores da OATP1B ou CYP3A. Não é esperada interação clinicamente significativa com medicamentos inibidores da P-gp, MATE2-K. MRP1 ou transportadores BCRP. REAÇÕES ADVERSAS: náusea, fadiga, vômito, alopecia, constipação, redução do apetite, anemia, neutropenia, diarreia, trombocitopenia, tosse, leucopenia, pirexia. POSOLOGIA: ENHERTU® deve ser administrado em infusão intravenosa a cada 3 semanas (ciclo de 21 dias), até progressão da doença ou toxicidade não manejável. Câncer de mama: a dose recomendada é 5,4 mg/kg. Câncer de pulmão: a dose recomendada é 5,4 mg/kg. Câncer gástrico: a dose recomendada é 6,4 mg/kg. Pode ser necessária a interrupção temporária, redução de dose ou descontinuação do tratamento com ENHERTU® em decorrência de reações adversas. USO RESTRITO A HOSPITAIS. VENDA SOB PRESCRIÇÃO MÉDICA. Reg. M.S.: 1.0454.0191. Registrado por: Daiichi Sankyo Brasil Farmacêutica Ltda. Serviço de Atendimento ao Consumidor: 08000-556596. Informações adicionais à disposição da classe médica. SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.
Material destinado exclusivamente a profissionais de saúde habilitados a prescrever e/ou dispensar medicamentos - 2532-552493 | BR-26729 | Dezembro/2023
