Destacado no programa científico do 2022 ESMO Immuno-Oncology Congress (ESMO-IO), ensaio clínico randomizado de Fase 3 (EMPOWER-Lung 3)1 apresentou resultados da parte I do estudo com o anti-PD-1 cemiplimabe (Libtayo®, Sanofi/Regeneron) em pacientes com câncer de pulmão não pequenas células (CPNPC) avançado, mostrando que a adição de cemiplimabe e do anti-CTLA-4 ipilimumabe a um curso reduzido de quimioterapia conferiu benefício significativo de sobrevida global em pacientes com CPNCP com expressão de PD-L1 <50%.
Destacado no programa científico do 2022 ESMO Immuno-Oncology Congress (ESMO-IO), ensaio clínico randomizado de Fase 3 (EMPOWER-Lung 3)1 apresentou resultados da parte I do estudo com o anti-PD-1 cemiplimabe (Libtayo®, Sanofi/Regeneron) em pacientes com câncer de pulmão não pequenas células (CPNPC) avançado, mostrando que a adição de cemiplimabe e do anti-CTLA-4 ipilimumabe a um curso reduzido de quimioterapia conferiu benefício significativo de sobrevida global em pacientes com CPNCP com expressão de PD-L1 <50%.
Dividido em duas partes, o estudo EMPOWER-Lung 3 (NCT03409614) demonstrou anteriormente que o anti-PD1 cemiplimabe em combinação com quimioterapia à base de platina (doublet de platina) atingiu seu endpoint primário de sobrevida global (SG) em pacientes adultos com câncer de pulmão não pequenas células (CPNPC) avançado sem mutações EGFR, ALK ou ROS1, tumores com histologia escamosa ou não escamosa e em todos os níveis de expressão de PD-L1. Os resultados foram publicados em agosto na Nature Medicine2.
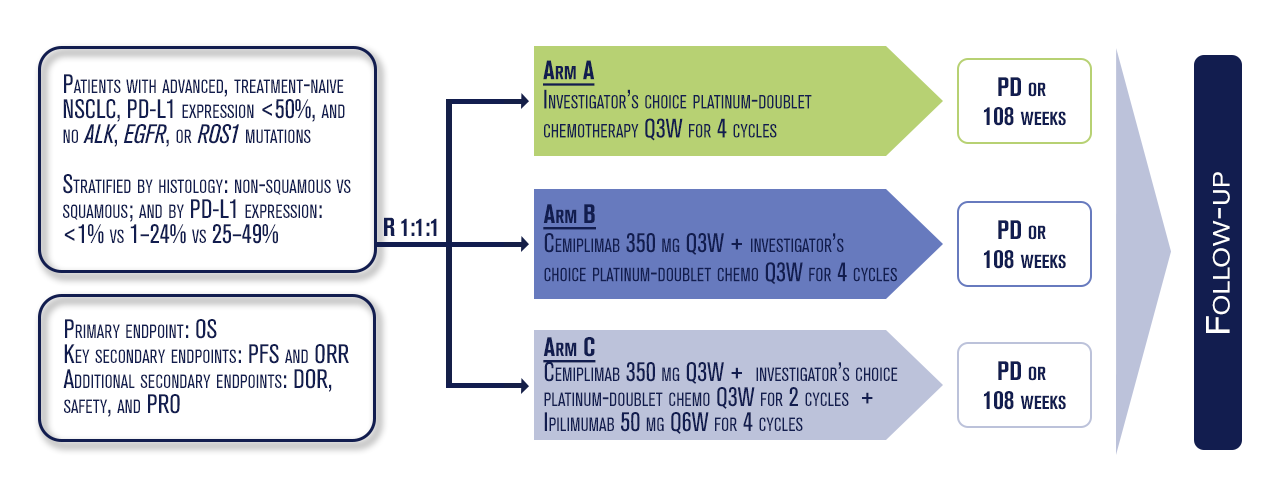
Neste ensaio clínico de Fase 3 foram elegíveis 1. 323 pacientes com expressão de PD-L1 <50%, randomizados (1:1:1) para: quimioterapia dupla padrão à base de platina por 4 ciclos (StC), cemiplimabe (cemi) 350 mg uma vez a cada 3 semanas (Q3W) por até 108 semanas + quimioterapia padrão, ou cemi 350 mg Q3W por até 108 semanas + um ciclo reduzido de quimioterapia por 2 ciclos + ipilimumabe 50 mg Q6W por até 4 ciclos (CIC). O endpoint primário foi sobrevida global (SG). Endpoints secundários incluíram sobrevida livre de progressão (SLP), taxa de resposta objetiva (ORR) e qualidade de vida, além da análise de segurança.
“Esse estudo está em linha com a construção de conhecimento que está acontecendo nesse momento. Sabemos que a imunoterapia, isolada ou em combinação, é um tratamento muito importante especialmente na população com alta expressão de PD-L1 (PD-L1 ≥ 50%). Agora, a ideia é entender como melhorar os resultados de pacientes que não são alto expressores de PD-L1 (PD-L1 <50%) ou que tem o PD-L1 negativo”, afirma Clarissa Baldotto, Diretora do Núcleo de Integração Oncológica da Oncologia D'Or, ressaltando que a inclusão de pacientes com PD-L1 <50% traz uma robustez na análise, porque em outros trabalhos acabaram incluindo pacientes com alta expressão de PD-L1, elevando a taxa de resposta e os resultados de sobrevida. “Chama a atenção que havia um grande número de pacientes com histologia escamosa, uma população de pior prognóstico”, acrescenta.
Resultados
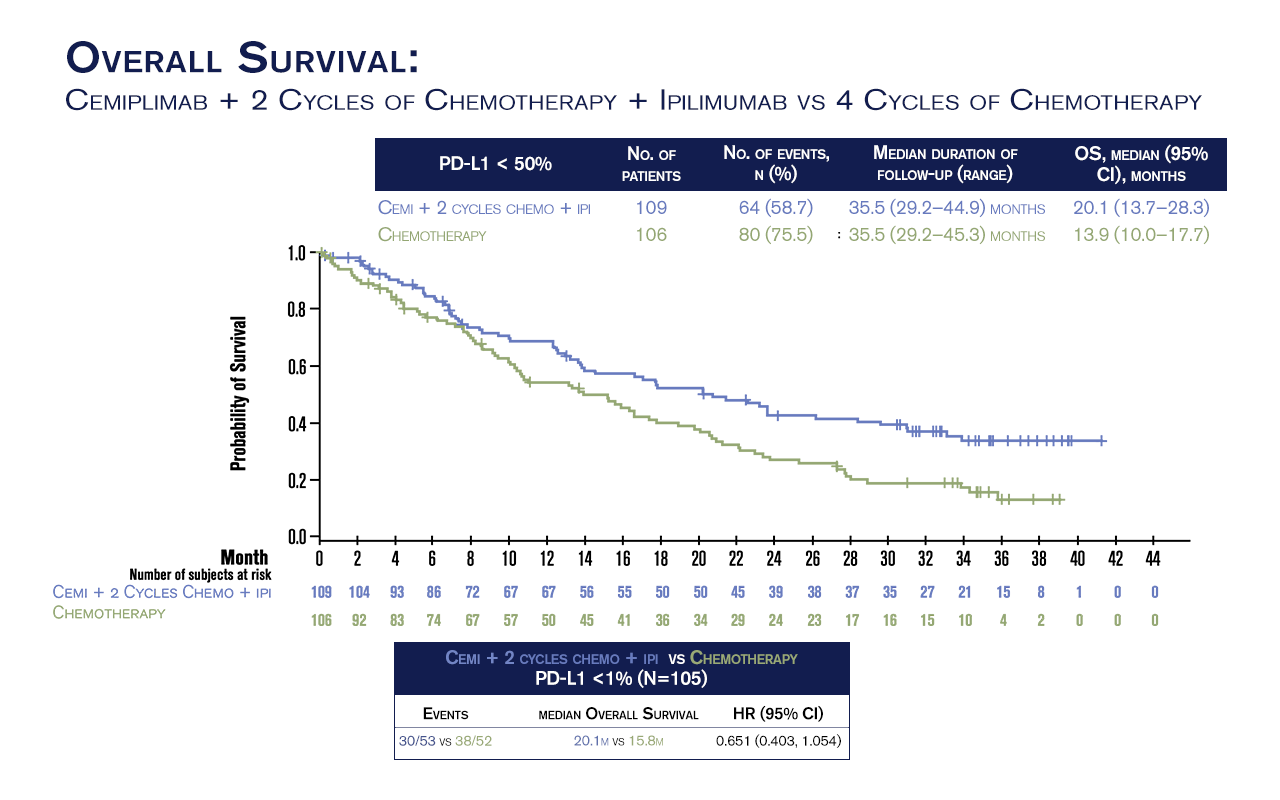
Em cada braço de análise, 49% dos pacientes tinham expressão de PD-L1 <1%. Em um seguimento mediano (med) de 35,5 meses (m), a SG med foi de 20,1m (13,7 a 28,3) para pacientes do grupo CIC (N=109) vs 13,9 (10,0 a 17,7) para pacientes do grupo StC (N=106), com razão de risco (HR) de 0,651 (intervalo de confiança de 95%, 0,441 a 0,857).
A mediana de SLP foi de 6,4m vs 6,3m com HR de 0,813 (0,596 a 1.108). A ORR alcançou 35,8% e 28,3% para CIC e StC, respectivamente. A mediana de duração de resposta foi de 15,9 meses versus 6,3 meses.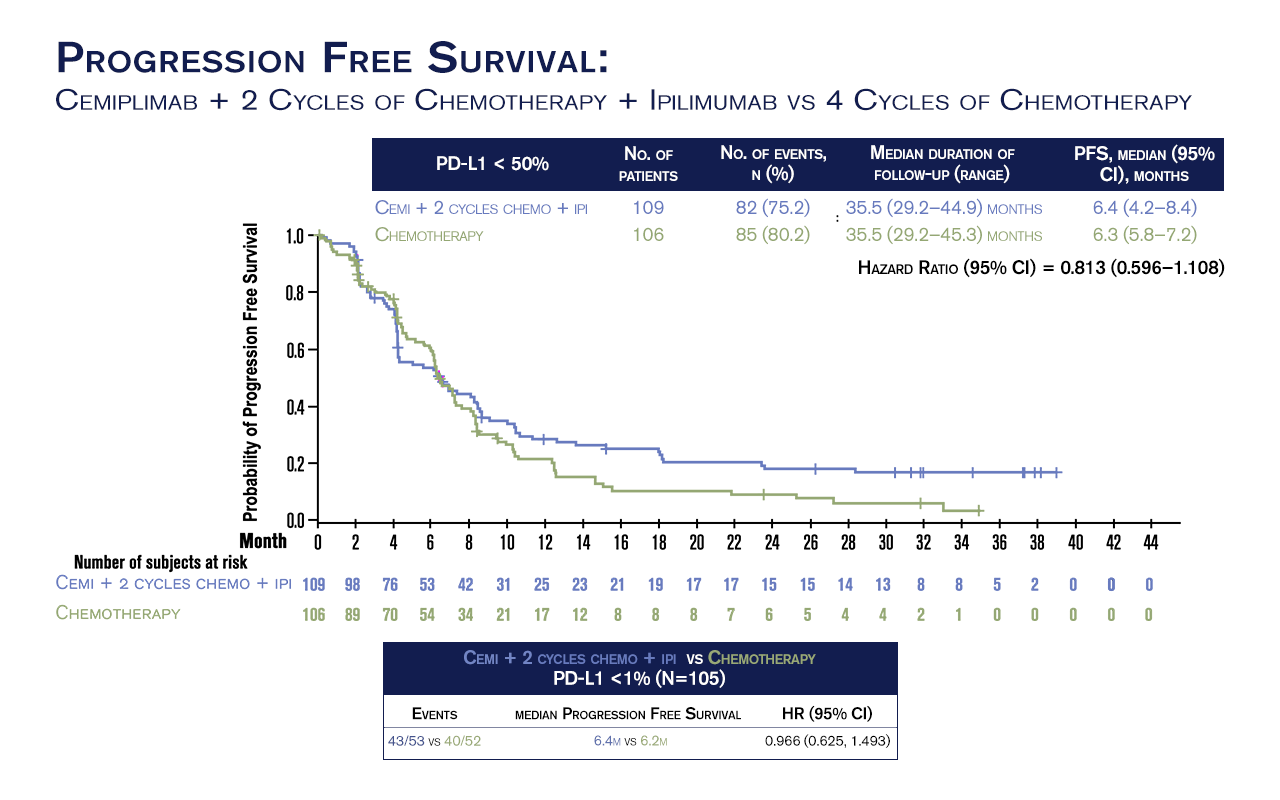
O perfil de segurança foi consistente com dados já conhecidos para cemiplimabe, quimioterapia e ipilimumabe. Eventos adversos emergentes do tratamento de grau 3 (TEAEs) foram observados em 43,1% dos pacientes CIC e 42,7% do grupo StC, resultando em descontinuação do tratamento do estudo ou morte em 4,6% vs 0% e em 4,6% vs 4,9%, de pacientes CIC e StC, respectivamente.
“Como esperado, houve um aumento da toxicidade com a combinação das 4 drogas, mas nada que chame atenção em termos da descontinuação ou mortes relacionadas ao tratamento, mostrando que os dois regimes são bem suportados”, avalia Zukin.
Clarissa ressalta que a redução da dose de ipilimumabe foi um ponto muito positivo, uma vez que que ipi tende a agregar uma certa toxicidade que é dose-dependente. “Com a dose menor, o que observamos foi um número não expressivo de pacientes com eventos adversos imunomediados, mesmo com a combinação de duas imunoterapias”, diz.
“É mais uma opção de tratamento, especialmente nesse subgrupo de pacientes que não é alto expressor de PD-L1, ou que tem PD-L1 negativo, um subgrupo de pacientes no qual a potencialização da imunoterapia tem um papel importante”, conclui Clarissa.
Este ensaio clínico tem financiamento da Sanofi/Regeneron e está registrado na ClinicalTrials.gov: NCT03409614.
ASSISTA SOBRE O MESMO TEMA
ESMO-I-O: cemiplimabe em combinação mostra benefício de sobrevida global no câncer de pulmão
Na TV ONCONEWS, os oncologistas Clarissa Baldotto e Mauro Zukin discutem os resultados do estudo randomizado de Fase 3 EMPOWER-Lung 3 part I, que avaliou cemiplimabe, doublet de platina e ipilimumabe no tratamento de primeira linha de pacientes com câncer de pulmão não pequenas células (CPNPC). Os resultados foram apresentados no Congresso ESMO – Immuno-Oncology 2022 (ESMO I-O 2022). Confira.
Referências:
1 - 122MO Cemiplimab (cemi) + platinum doublet chemotherapy (chemo) + ipilimumab (ipi) for first-line treatment of advanced non-small cell lung cancer (NSCLC): EMPOWER-Lung 3 part I - Baramidze, A. et al. - Annals of Oncology (2022) 16 (suppl_1): 100104-100104. 10.1016/iotech/iotech100104. https://oncologypro.esmo.org/meeting-resources/esmo-immuno-oncology-congress/cemiplimab-cemi-platinum-doublet-chemotherapy-chemo-ipilimumab-ipi-for-first-line-treatment-of-advanced-non-small-cell-lung-cancer-nsclc
2 - Gogishvili, M., Melkadze, T., Makharadze, T. et al. Cemiplimab plus chemotherapy versus chemotherapy alone in non-small cell lung cancer: a randomized, controlled, double-blind phase 3 trial. Nat Med 28, 2374–2380 (2022). https://doi.org/10.1038/s41591-022-01977-y ou https://www.nature.com/articles/s41591-022-01977-y
--








