Bottom Line
O diagnóstico de leucemia mieloide aguda (LMA) deve ser feito baseado em achados clínicos, morfológicos, imunofenotípicos, moleculares e citogenéticos. O tratamento clássico da LMA divide-se em indução (com antracíclico e citarabina) e consolidação. Os antracíclicos classicamente utilizados são a idarrubicina e a daunorrubicina. Na terapia de consolidação, o uso de dois a quatro ciclos de citarabina em altas doses, o transplante autólogo e o transplante alogênico têm sido utilizados de acordo com o prognóstico do paciente.
Nelson Hamerschlak (foto) é Professor livre-docente pela Faculdade de Medicina da Universidade de São Paulo (USP) e coordenador do Programa de Hematologia e Transplantes de Medula Óssea do Hospital Israelita Albert Einstein (HIAE).
Nelson Hamerschlak1
1 Professor livre-docente pela Faculdade de Medicina da Universidade de São Paulo (USP) e coordenador do Programa de Hematologia e Transplantes de Medula Óssea do Hospital Israelita Albert Einstein (HIAE)
Resumo
A leucemia mieloide aguda (LMA) tem incidência de 3,5 casos por milhão de habitantes por ano. Apresenta aumento expressivo acima dos 60 anos, com mediana de ocorrência em torno dos 65 anos.
O diagnóstico deve ser feito baseado em achados clínicos, morfológicos, imunofenotípicos, moleculares e citogenéticos. Clinicamente os pacientes podem se apresentar com fadiga, febre, manchas pelo corpo, dores ósseas ou articulares. Ao exame físico, verificam-se palidez, sangramentos cutâneo-mucosos, febre e visceromegalias. Mais raramente, os doentes podem apresentar infiltração de pele, gengiva, tumores extramedulares e sinais de infiltração de sistema nervoso central, expressa como cefaleia ou paralisia de nervos cranianos
Em LMA, a avaliação prognóstica pode determinar a escolha do tratamento e deve considerar performance status, idade, comorbidades, existência de doador compatível; fatores ligados à biologia da doença, como alterações cromossômicas, resposta à terapêutica, leucemia secundária versus de novo, morfologia (classificação FAB), imunofenótipo, fatores genético-moleculares e até fatores relacionados ao ambiente, como recursos e condições socioeconômicas.
O tratamento clássico da LMA divide-se em indução e consolidação. A indução com antracíclico e citarabina é utilizada há mais de 40 anos. Os antracíclicos classicamente utilizados são a idarrubicina e a daunorrubicina.5 Na terapia de consolidação, o uso de dois a quatro ciclos citarabina em altas doses, o transplante autólogo e o transplante alogênico têm sido utilizados de acordo com o prognóstico do paciente.
O futuro do tratamento, principalmente em casos de prognóstico mais reservado, deverá contar com o auxílio da genômica, novas drogas e terapia-alvo.
Palavras-chave: LMA, leucemia mieloide aguda, diagnóstico, ‘fatores prognósticos’, ‘tratamento de indução’, ‘tratamento de consolidação’
Introdução
A leucemia mieloide aguda (LMA) incide com uma frequência de 3,5 casos por milhão de habitantes por ano e sua incidência aumenta com a idade. Apresenta aumento expressivo acima dos 60 anos e considera-se a idade mediana de ocorrência em torno dos 65 anos.1-3 No Brasil, segundo o Instituto Nacional do Câncer (INCA), estima-se a incidência de 8 mil a 9 mil casos por ano.4
Sabe-se que a ocorrência da LMA pode estar ligada a diversos fatores, como radiações ionizantes; exposição a produtos químicos, exposição prévia a quimioterápicos, fatores genéticos, doenças congênitas e síndromes de falência medular. Mas, na maioria dos casos, esses fatores não são identificados.5
Do ponto de vista fisiopatológico, os efeitos da doença ocorrem por invasão das células doentes (blastos), insuficiência medular, disfunção de microambiente, defeitos na proliferação e função das células normais remanescentes e disfunção global do sistema imune. A doença se caracteriza, no final, por citopenias periféricas e invasão por células blásticas.6
Diagnóstico
O diagnóstico deve ser feito baseado em achados clínicos, morfológicos, imunofenotípicos, moleculares e citogenéticos.7 Clinicamente, os pacientes podem se apresentar com fadiga, febre, manchas pelo corpo, dores ósseas ou articulares. Ao exame físico, verificam-se palidez, sangramentos cutâneo-mucosos, febre e visceromegalias. Mais raramente, os doentes podem apresentar infiltração de pele, gengiva, tumores extramedulares e sinais de infiltração de sistema nervoso central, expressa como cefaleia ou paralisia de nervos cranianos.6
Para análise morfológica, recomenda-se que sejam contados 200 leucócitos no sangue periférico e 500 células nucleadas na medula óssea. Segundo critérios da Organização Mundial da Saúde, considera-se LMA a presença de número maior ou igual a 20% de blastos, exceto nos casos de t(15:17),t(8:21), inversão do cromossomo 16 ou t(16:16).7
A imunofenotipagem tem como objetivos analisar as linhagens celulares, caracterizar o estado maturativo das células e detectar expressões imunofenotípicas anômalas que podem ser úteis para o acompanhamento da doença residual mínima. A Tabela 1 apresenta os principais marcadores para o diagnóstico da LMA.8-10
Tabela 1.Principais marcadores imunofenotípicos para leucemia mieloide aguda
|
Precursores mieloides |
CD34, CD38, CD117, CD133, HLA-DR |
|
Linhagem granulocítica |
CD13, CD 15, CD 16, CD33, CD65, MPOc |
|
Linhagem monocítica |
CD11c, CD14, CD64, CD4, CD11b, CD36, lisozima |
|
Linhagem megacariocítica |
CD41, CD61, CD42 |
|
Linhagem eritroide |
CD235a (glicoforina A) |
Diversas alterações citogenéticas podem ocorrer na LMA, descrevendo-se como muito graves as monossomais e as alterações complexas. O Quadro 1 mostra as alterações citogenéticas de especial interesse nas LMAs.8-10
Quadro 1.Principais alterações citogenéicas encontradas em leucemia mieloide aguda (LMA)
|
t(8;21)(q22;q22); RUNX1-RUNX1T1: 5% das LMAs |
|
inv(16)(p13.1q22); t(16;16)(p13.1;q22); CBFB-MYH11: 5-8% das LMAs |
|
t(15;17)(q22;q12); PML-RARA: 5-8% das LMAs |
|
t(9;11)(p22;q23); MLLT3-MLL: 9-12% (crianças); 2% (adultos) |
|
t(6;9)(p23;q34); inv(3)(q21q26.2); t(3;3)(q21;q26.2); t(1;22)(p13;q13) |
Costumamos classificar as LMAs como de novo ou secundárias à mielodisplasia e/ou quimioterapia ou radioterapia, sendo estas últimas de pior prognóstico. A classificação franco-americana-britânica (FAB) foi adotada por muitos anos, considerando apenas características morfológicas e dividindo as LMAs em M0, M1, M2, M3, M4, M5, M6 e M7 (Tabela 2), enquanto a classificação da Organização Mundial da Saúde de 2008 é a que vigora atualmente e é baseada em risco (Quadro 2).11
Tabela 2. Classificação FAB (franco-americana-britânica) baseada na citologia em sete subtipos da leucemia mieloide aguda (LMA)
|
M1 |
LMA sem maturação (mais de 90% de blastos mieloides, com menos de 10% de elementos mieloides maturando) |
|
M2 |
LMA com maturação (mais de 30% de blastos, até 89%, com mais de 10% das células anormais, sendo de pró-mielócitos até células mais maduras) |
|
M3 |
Leucemia pró-mielocítica aguda |
|
M4 |
Leucemia mielomonocítica aguda (os blastos mieloides devem exceder a 30% das células medulares nucleadas não eritroides, sendo 20 a 80% de monoblastos) |
|
M5 |
Leucemia monocítica aguda (mais de 30% das células medulares nucleadas não eritroides são blastos, sendo mais de 80% precursores de monócitos) |
|
M6 |
Eritroleucemia aguda ou síndrome de Di Guglielmo (mais de 50% dos elementos nucleados da medula devem ser eritroblastos e mais de 30% dos elementos não eritroides devem ser blastos mieloides) |
|
M7 |
Leucemia megacariocítica aguda |
Quadro 2. Classificação da Organização Mundial de Saúde (OMS) para as leucemias agudas11
|
Leucemia mieloide aguda e neoplasias relacionadas |
|
Leucemia mieloide aguda (LMA) com anormalidades genéticas recorrentes |
|
LMA com t(8;21)(q22;q22); RUNX1-RUNX1T1 |
|
LMA com inv(16)(p13.1q22) ou t(16;16)(p13.1;q22); CBFB-MYH11 |
|
LMA com t(15;17)(q22;q12); PML-RARA |
|
LMA com t(9;11)(p22;q23); MLLT3-MLL |
|
LMA com t(6;9)(p23;q34); DEK-NUP214 |
|
LMA com inv(3)(q21q26.2) ou t(3;3)(q21;q26.2); RPN1-EVI1 |
|
LMA (megacarioblástica) com t(1;22)(p13;q13); RBM15-MKL1 |
|
Leucemia mieloide aguda relacionada a transformação de mielodisplasia |
|
Leucemia mieloide aguda, sem outra classificação específica: |
|
LMA com diferenciação mínima |
|
LMA sem maturação |
|
LMA com maturação |
|
Leucemia mielomonocítica aguda |
|
Leucemia monoblástica/monocítica aguda |
|
Leucemia eritroide aguda |
|
Leucemia eritroide pura |
|
Eritroleucemia, eritroide/mieloide |
|
Leucemia megacarioblástica aguda |
|
Leucemia basofílica aguda |
|
Panmielose com mielofibrose aguda |
|
Sarcoma mieloide |
|
Proliferação mieloide relacionada com a síndrome de Down |
|
Mielopoese anormal transitória |
|
Leucemia mieloide associada com a síndrome de Down |
|
Neoplasia blástica plasmacitoide de células dendríticas |
Fatores prognósticos
Em LMA, talvez um dos mais importantes capítulos seja a avaliação prognóstica, uma vez que esta pode determinar a escolha do tratamento do paciente. Diversos estudos têm sido publicados neste sentido e normalmente consideram aqueles fatores ligados aos pacientes, como “performance status”, idade, comorbidades, existência de doador compatível; fatores ligados à biologia da doença, como alterações cromossômicas, resposta à terapêutica, leucemia secundária versus de novo, morfologia (classificação FAB), imunofenótipo, fatores genético-moleculares e até fatores relacionados ao ambiente, como recursos e condições socioeconômicas.
Classicamente, o cariótipo vinha sendo utilizado como principal fator prognóstico nas leucemias de novo. A Tabela 3 separa os casos em prognóstico favorável, desfavorável e intermediário de acordo com o cariótipo.8-10 Tendo em vista que mais que mais de 40% das LMAs apresentam cariótipo normal e sabendo-se sobre a variabilidade de evolução desses pacientes, a descrição de fatores e mutações genético-moleculares, como NPM1 em 55% dos casos, FLT3-ITD (40%), MLL-PTD (6%), NRAS (8-10%), CEBPA (10%), FLT3-TKD (6%), podem contribuir no aprimoramento das medidas prognósticas.12-15 Destas, FLT3-ITD, NPM1 e CBPA são as que mais têm sido utilizadas na prática clínica.12-15 A presença da mutacão c kit também tem sido utilizada no sentido de demonstrar casos de t (8:21) ou inv(16) com prognóstico ruim.16 15
Tabela 3. Prognóstico da leucemia mieloide aguda (LMA) de acordo com cariótipo
|
Prognóstico favorável |
t(15;17) |
|
t(8;21) |
|
|
Inv(16) e t(16:16) |
|
|
Prognóstico intermediário |
Cariótipo normal |
|
t(9;11), -y, +8, +6, del 12(p) |
|
|
Prognóstico desfavorável |
t(6;9), -7, -5 |
|
Alterações complexas |
Assim sendo, é considerado fator de bom prognóstico quando pacientes têm cariótipo normal, com FLT3 negativo e NPM1 positivo, e aqueles com CBPA e com inv16, t(8:21) sem mutação do c kit. Os demais são de prognóstico intermediário ou desfavorável.16 O European Leukemia Net17 passou a classificar então as LMAs como de prognóstico favorável, intermediário I, intermediário II e desfavorável, conforme a Tabela 4.
Tabela 4. Classificação prognóstica European Leukemia Net17
|
Grupo genético |
Alterações |
|
Favorável |
t(8:21)(q22;q22),RUN X1-RUNX1T1 |
|
Inv(16)(p13.1q22) ou t(16;16) (p13.1;q22); CBFB- MYH11 |
|
|
NPM1 mutado sem FLT3-ITD (cariótipo normal) |
|
|
CEBPA mutado (cariótipo normal) |
|
|
Intermediário I |
NPM1 e FLT3-ITD mutados (cariótipo normal) |
|
NPM1 e FLT3 negativos (cariótipo normal) |
|
|
NPM1 negativo e FLT3 positivo (cariótipo normal) |
|
|
Intermediário II |
t(9:11) (p22;q23); MLLT3-MLL |
|
Achados citogenéticos não classificados como favoráveis ou adversos |
|
|
Adverso |
Inv(3) (q21q26.2) ou t(3;3) (q21:q26.2); RPN1- EVI1 |
|
t(6;9)(p23;q34); DEK-NUP 214 |
|
|
t(v;11) (v;q23); rearranjo MLL |
|
|
-5 ou del (5q) |
|
|
-7 |
|
|
anl (17p) |
|
|
cariótipo complexo |
Em nosso serviço, temos adotado o algoritmo da Figura 1 para indicação de quimioterapia de consolidação com transplantes de medula óssea autólogo ou alogeneico. Levamos em consideração o c kit para casos de t(8;21), inv(16) ou t(16;16).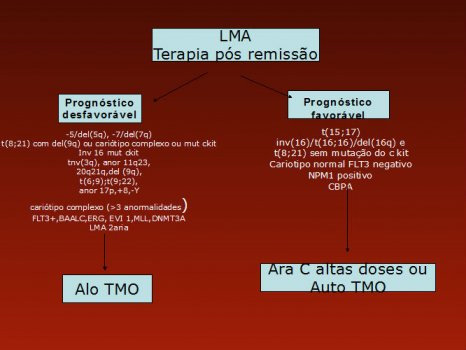
Novas alterações são identificadas e seu valor no manuseio clínico da LMA vem sendo estudado: mutações do TET2, ASXL1, IDH1 e IDH2. PHF6 e DNMT3A.18-22 Parece que a mutação do IDH2 R140, mas não IDH2 R172 ou IDH1 foi associada com melhora da sobrevida global. Mutações do ASXL1 PHF6, por outro lado, foram associadas a piora de sobrevida geral.18-22 Recentemente, metanálise de estudos incluindo mais de 4.500 pacientes com LMA mostrou que DNMT3A está associado aos subtipos M4 e M5 e que constitui um marcador adverso independente. Os autores desse estudo recomendam a incorporação dessa mutação nos algoritmos de decisão de pacientes com LMA.23
Tratamento
O tratamento clássico da LMA divide-se em indução e consolidação. O tratamento clássico de indução com antracíclico e citarabina é utilizado há mais de 40 anos. Estudos com adição de outras drogas ou mesmo com aumento da dose de citarabina não demonstraram superioridade nas taxas de remissão, que variam de 60 a 80%.24,25 Os antracíclicos classicamente utilizados são a idarrubicina e a daunorrubicina.24,25 Na terapia de consolidação, o uso de dois a quatro ciclos citarabina em altas doses, o transplante autólogo e o transplante alogênico têm sido utilizados de acordo com o prognóstico do paciente.26,27
O futuro do tratamento da LMA, principalmente em casos de prognóstico mais reservado, deverá contar com o auxílio da genômica, com painéis de alterações genéticas ou sequenciamento, novas drogas e terapia-alvo. Hoje algumas destas estratégias já estão sendo utilizadas na prática clínica como em estudos clínicos, destacam-se Mylotarg (anti CD 33), o uso de inibidores do FLT3 e do IDH 1, o ATRA (ácido all-trans retinoico) em conjunto com quimioterapia na presença do NPM1, o uso de hipometilantes nas leucemias secundárias e em idosos, inibidores de histona-deacetilase, inibidores do AKT/m Tor, clofarabina, agentes apoptóticos como anti bcl-2 , genasense, e moduladores MDR, como zosuquidar.27,28
Leucemia promielocítica aguda
A leucemia promielocítica aguda, denominada M3 pela classificação FAB, corresponde a 10 a 15% das LMAs. Morfologicamente, caracteriza-se por presença de promielócitos anormais, com núcleo excêntrico e granulações no citoplasma. Apresenta também muitos bastonetes de Auer formando feixes. Imunofenotipicamente, apresenta alta expressão de antígenos mielo-monocíticos (CD13, CD15 e CD33) e ausência de expressão de antígenos monocíticos (CD14, incluindo My4, Leu M3 e Mo2) e HLA-DR. A presença da translocação t(15:17) (q22: q21) ocorre praticamente na totalidade dos casos e resulta na fusão dos genes PML RARa.29
Clinicamente, a leucemia promielocítica aguda apresenta-se com quadro de coagulação intravascular disseminada, sendo a hemorragia a principal causa de morte nesses pacientes. O tratamento mudou muito com o advento do ATRA associado à quimioterapia.29,30
O grupo espanhol (PETHEMA) estabeleceu um protocolo de tratamento mostrando a importância dos antracíclicos associados ao ATRA na evolução e cura da doença e definiu uma classificação de risco baseada na contagem de leucócitos e plaquetas, propiciando terapêutica individualizada para cada caso, com altas chances de cura.31
O tratamento clássico consta de indução, consolidacão e manutenção. O trióxido de arsênico (ATO) é frequentemente utilizado em pacientes que sofrem de recidiva da doença, mas há diversos trabalhos associando ATRA e ATO na primeira linha, principalmente para casos de baixo risco, com resultados semelhantes ao uso de ATRA e quimioterapia.32
Leucemias em idosos
Classicamente, os resultados de tratamento na LMA do idoso são muito ruins. Esses pacientes frequentemente têm performance status comprometido, alta incidência de doença residual mínima após tratamento, citogenéticas desfavoráveis, mortalidade alta relacionada ao tratamento, maior incidência de falha de indução, remissões mais curtas e menor sobrevida geral.33,34
O envelhecimento da população, que chega à idade avançada na maioria das vezes com condições clínicas adequadas, vem fazendo com que o mundo se adapte a estratégias mais agressivas de tratamento. A avaliação geriátrica ampla, os índices de comorbidades e esquemas terapêuticos menos tóxicos possibilitam estratégias de tratamento curativas nesses pacientes.35
Na indução, devemos considerar o esquema padrão 3 + 7 (antracíclico + citarabina), com taxas de remissão de 60%, lembrando-se sempre que a sobrevida livre de progressão é curta (5 a 10 meses) e a manutenção da remissão por mais de dois anos é menor que 10%.36-38 O uso de agentes hipometilantes como 5-azacitidina e decitabina são importantes de serem considerados, principalmente em pacientes mais frágeis ou com leucemias secundárias. Destacam-se aqui os trabalhos com altas doses de decitabina e taxas de remissão completa em torno de 50%.39
Na consolidação de pacientes idosos, deve-se considerar aqueles de prognóstico favorável, isto é, que não apresentem t(15;17), t(8:21) e inv16, com c-kit negativo, ou cariótipo normal com FLT3 negativo e NPM1 positivo. Estes deverão ser submetidos a consolidações com doses intermediárias de citarabina, com 1 a 1,5 g de 12 em 12 horas, por 3 dias, ou mesmo transplante autólogo. Anti Bcl-2 e Mylotarg em baixas dosescom quimioterapia devem ser usados em casos refratários.Aqueles com fatores prognósticos desfavoráveis e com boa avaliação geriátrica global devem ser selecionados (caso tenham menos de 80 anos) ao transplante não mieloablativo ou de intensidade reduzida.40-42
Leucemia mieloide aguda e transplante de medula óssea no brasil
Dados de diversos autores brasileiros mostravam que o tratamento da LMA no Brasil apresentava resultados desanimadores.43 41 Desde o ano de 2005, a Sociedade Brasileira de Transplantes de Medula Óssea (SBTMO) vem incentivando estudos multicêntricos e avaliação dos diversos centros de tratamento no país com o intuito de monitorar e até tentar melhorar os resultados encontrados com o transplante de medula óssea.
Várias iniciativas podem ser aqui destacadas. Entre 2005 e 2007, dados de 1.289 pacientes em 17 centros de tratamento em São Paulo, Rio de Janeiro, Paraná, Pernambuco e Rio Grande do Sul foram avaliados retrospectivamente. Os transplantes em LMA representavam 16% dos transplantes realizados no Brasil com 27%, segundo dados do Center for International Blood and Marrow Transplant Research (CIBMTR) nessa época. Os esquemas de condicionamento utilizados foram principalmente busulfano e cilofosfamida, busulfano e melfalano e TBI (irradiação corporal total) e ciclofosfamida.44
Nesse estudo, não havia classificação prognóstica por citogenética e o transplante autólogo, de uma forma geral, tinha resultados interessantes e muito semelhantes ao alogênico. Este dado deve ser analisado considerando que, o Brasil, pelo menos nessa época, seguia uma tendência mais europeia do que norte-americana de valorizar este tipo de procedimento. Os dados de sobrevida semelhantes entre as duas modalidades de transplantes eram explicados pela maior mortalidade nos autólogos por recidiva (60%) do que por toxicidade (40%), invertendo-se essas porcentagens no transplante alogênico.44.
Os dados brasileiros de sobrevida pós transplante foram posteriormente validados por Marcelo Pasquini, do CIBMTR, que apresentou as curvas para doença precoce, intermediária e avançada de dados brasileiros encaminhados ao CIBMTR, conforme Figura 2. [*]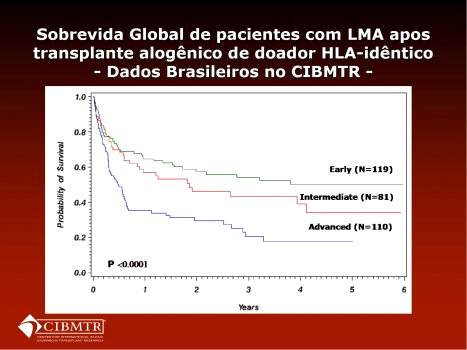
Figura 2. Dados apresentados por Marcelo Pasquini, do Center for International Blood and Marrow Transplant Research (CIBMTR), classificando transplantes de centros brasileiros que informaram o registro internacional.
De 2007 a 2012, algumas iniciativas no Brasil merecem destaque na área:
- A experiência com o uso de busulfano oral ou endovenoso associado à fludarabina;45,46
- Um estudo de avaliação de como os pacientes com LMA eram tratados no Brasil;47
- Estudo de pacientes idosos com transplante de medula óssea com esquema de toxicidade reduzida;48
- Dois consensos (2009 e 2012) sobre transplante de medula óssea realizados pela Sociedade Brasileira de Transplantes de Medula Óssea.49,50
O grupo conhecido como “Conexão Caipira”, liderado pelo Centro de Transplantes de Jaú, mostrou que o uso do busulfano oral e fludarabina mostrava uma curva de sobrevida de 64% em dois anos (Figura 3).45 Os resultados com busulfano endovenoso e fludarabina foram publicados pelo nosso grupo, principalmente com pacientes em idade avançada, mostrando sua eficácia (Figura 4) e baixa toxicidade.46
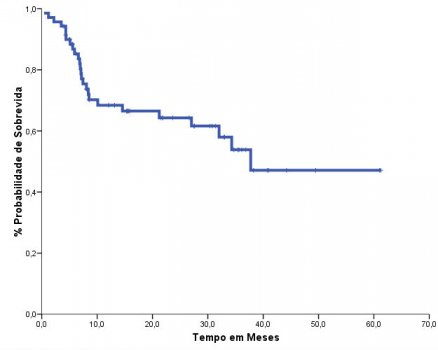
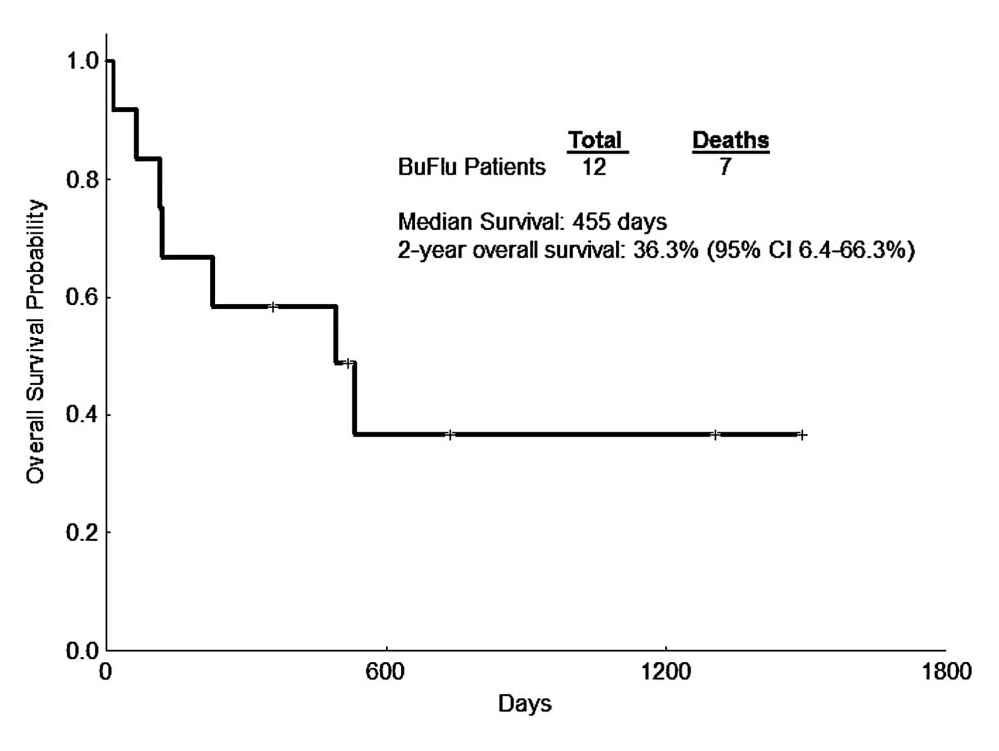 Figura 4.Sobrevida geral com busulfano (BU) endovenoso e fludarabina (FLU) em pacientes com leucemia mieloide aguda (LMA).
Figura 4.Sobrevida geral com busulfano (BU) endovenoso e fludarabina (FLU) em pacientes com leucemia mieloide aguda (LMA).
Com o objetivo de avaliar as condições como os pacientes com LMA são diagnosticados e tratados no Brasil, um questionário foi enviado aos centros brasileiros de tratamento. Os resultados obtidos mostraram que:47
- Os centros considerados de referência e que realizam transplantes de medula óssea utilizam os meios diagnósticos e prognósticos em mais de 90% dos pacientes, enquanto em outros lugares, ainda se carece de citogenética e mesmo imunofenotipagem para diagnóstico, sendo que apenas 50% das instituições que tratam pacientes mas não realizam transplantes estavam utilizando essas metodologias;
- Com relação aos estudos moleculares, o PML/RARA era realizado ou encaminhado para realização por mais de 80% das instituições consultadas, enquanto o FLT3 por 45% e NPM1 por menos de 15% delas;
- Citarabina e idarrubicina eram a terapêutica indução utilizada por 36% das instituições, e danunorrubicina e citarabina por 64% delas;
- Na consolidação, 91% das instituições indicavam alotransplante para risco intermediário e 100% para os de alto risco, caso tivessem doador identificado;
- Nos pacientes de baixo risco, 70% consolidavam com altas doses de citarabina e 30% com autotransplante de medula óssea.
Os transplantes em idosos vêm se tornando uma prática cada vez mais frequente em nosso meio. A primeira iniciativa brasileira se deu por nossa instituição associada ao MD Anderson Cancer Center, em estudo publicado em 2011, com resultado mostrando sobrevida importante em pacientes entre a 60a e 80a décadas de vida.48 A sobrevida de pacientes em dois anos tratados em primeira remissão chegou a 71%, em segunda remissão 44% e com doença ativa, 32%. De forma interessante, observamos que 58% morriam de recidiva da doença e não de toxicidade do transplante (42%).48
Destaque importante na área de leucemias no Brasil foi o trabalho coordenado pelo professor Eduardo Rego em um consórcio latino-americano, em colaboração com a Associação Americana de Hematologia, para melhorar os resultados no tratamento das leucemias promielocíticas agudas. Utilizando-se de um protocolo baseado no grupo espanhol com classificação de risco (PETHEMA) e de laboratórios ágeis e centralizados de diagnóstico molecular, conseguiu resultados em países em desenvolvimento semelhantes aos dados internacionais, como demonstra a Figura 5.51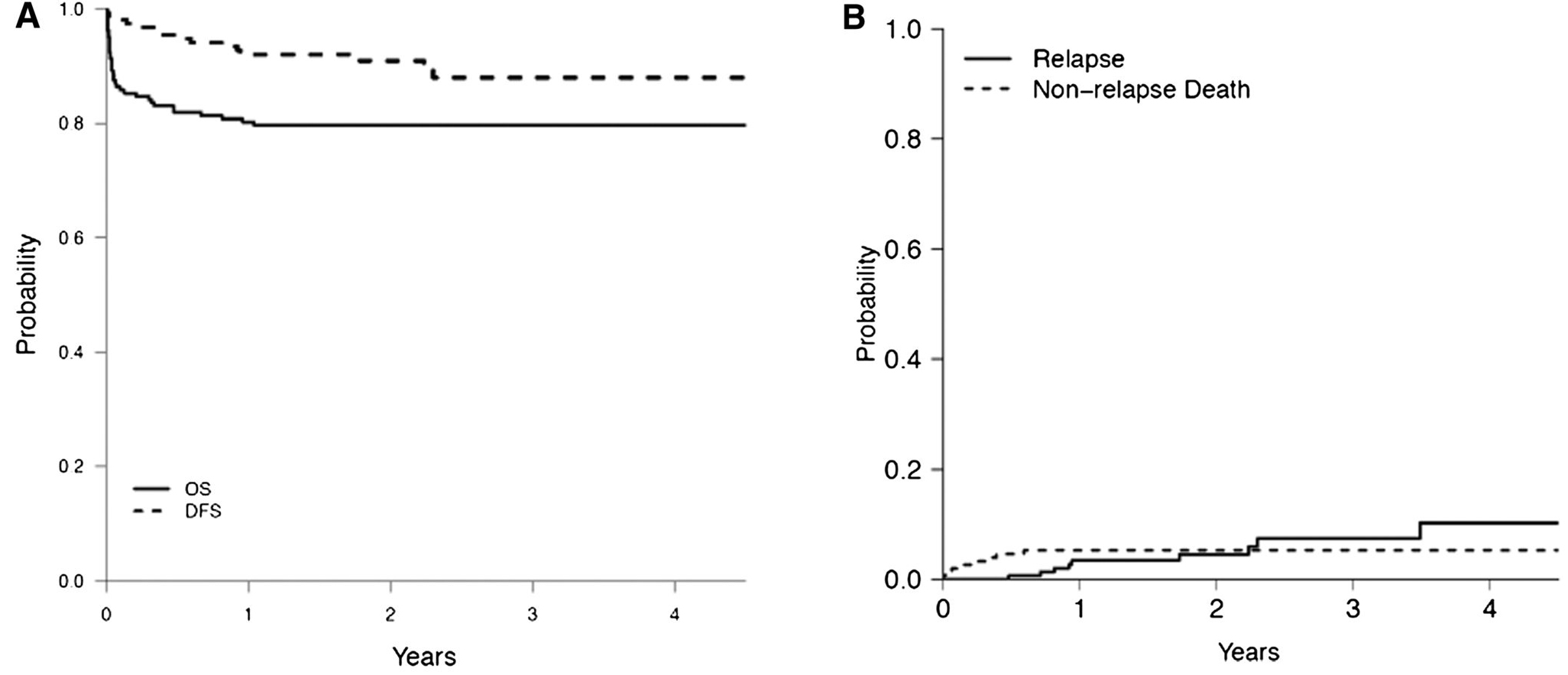
Figura 5.A: Sobrevida geral e sobrevida livre de doença. B Incidência cumulativa de recidiva e de óbitos não relacionados à recidiva
Finalmente, no período de 2012 e 2015, iniciativas como dose-alvo de busulfano, melhorias de nossas ferramentas diagnósticas/prognósticas, o Consenso da Sociedade Brasileira de Transplantes de Medula Óssea (SBTMO) 2015, ainda não publicado consolidando os consensos de 2009 e 201249,50 e o desenho de um protocolo para avaliar o auto transplante versus quimioterapia na consolidação de pacientes de baixo risco, mostra que os especialistas continuam ativos no Brasil, buscando cada vez melhores condições diagnósticas, prognósticas e terapêuticas.
A SBTMO realizou, em 2009, 2012 e 2015, reuniões de especialistas para estabelecer o consenso em transplantes de medula óssea no Brasil nas indicações, regimes de condicionamento, profilaxia e tratamento de doença do enxerto contra o hospedeiro.
Com relação à LMA, as principais recomendações foram:50,52
1. Basear a indicação dos transplantes alogênicos, autólogos e quimioterapia de consolidação em primeira remissão nos fatores prognósticos dos pacientes. Assim, pacientes de prognóstico intermediário e desfavorável seriam dirigidos ao transplante alogênico, enquanto os de prognóstico favorável, à quimioterapia de consolidação com altas doses de citarabina ou o transplante autólogo;
2. Apesar do conhecimento de que, na segunda remissão ou em doença avançada ou mesmo refratária, o transplante tem pior prognóstico, aceitá-lo nestas condições;
3. Os principais regimes de condicionamento recomendados seriam busulfano e ciclofosfamida e busulfano e fludarabina, sendo que, sempre que possível, a dosagem de busulfano seria recomendada;
4. O transplante em idosos é indicado em pacientes com bom estado geral e com poucas comorbidades, de preferência com avaliação geriátrica ampla.
Atingir níveis adequados de busulfano parece influenciar o resultado dos transplantes. Sendo assim, doses com área sob a curva (AUC) de 6.000 µMol.min podem ser usadas em pacientes com doenças mais agressivas, mais jovens ou mesmo com doença ativa, enquanto doses de 4.000 µMol.min são as ideais nos transplantes de baixa toxicidade utilizados em pacientes com mielofibrose, portadores de LMA com comorbidades e idosos.53
No Brasil, não se realiza rotineiramente a dosagem de busulfano. Ela é particularmente indicada quando do uso do busulfano oral, em que a absorção é errática. No entanto, poucos centros de tratamento possuem a tecnologia de HPLC (cromatografia líquida de alta performance ou pressão) ou UPLC (ultra performance) para realizar as dosagens. Com o intuito de obter uma dosagem prévia aos transplantes que fosse capaz de predizer a dose a ser ministrada nos pacientes, tese de doutorado de Iracema Esteves foi realizada com tecnologia desenvolvida no Einstein através do programa PROADI do Ministério da Saúde.53 Realizava-se a dosagem prévia de 48 horas até 15 dias antes do transplante, comparando-se com as dosagens durante o procedimento. Demonstrou-se que essa estratégia era factível para o uso do busulfano endovenoso mas não exata para o uso da droga oral.53
Outro projeto realizado com recursos PROADI foi a implantação dos testes moleculares prognósticos FLT3, NPM1, CEBPA e c-kit no nosso meio e a disponibilização deles para os serviços privados e públicos. Pudemos observar que a incidência de FLT3, NPM1 e CEBPA em pacientes com cariótipo normal eram respectivamente 19%, 17% e 1%. A mutação c-kit entre casos de t(8:21) ou inversão do cromossomo 16 era de 3%. Utilizando as ferramentas de citogenética e esses achados moleculares, pudemos classificar nossos pacientes, de acordo com a European Leukemia Net”,54 conforme Figura 6.
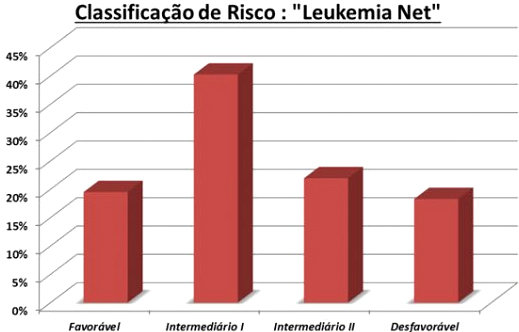
Figura 6. Classificação de risco de 100 pacientes com leucemia mieloide aguda (LMA) estudados no projeto LMA Brasil de acordo com a classificação do European Leukemia Net.
Com base nos excelentes resultados obtidos no consórcio da leucemia promielocítica aguda e no fato de que, para o Brasil, o transplante autólogo pode ser uma estratégia de consolidação mais adequada para pacientes de baixo risco, um grupo de pesquisadores brasileiros, liderados por Eduardo Rego, pretende implantar um estudo multicêntrico para avaliar a melhor estratégia de consolidação, ou seja quimioterapia com altas doses de citarabina versus autotransplante de células-tronco hematopoiéticas.
Quando fazemos uma retrospectiva dos resultados obtidos na literatura no tratamento da LMA e os esforços no Brasil neste sentido, a comunidade científica se sente esperançosa em chegar a resultados cada vez melhores. Devemos lembrar, no entanto, que, em nosso país, existem desigualdades profundas e condições de tratamento muitas vezes desfavoráveis, provocando distorções que devem ter a atenção de nossas autoridades para sua correção.
Referências
1. Yamamoto JF, Goodman MT. Patterns of leukemia incidence in the United States by subtype and demographic charactheristics, 1997-2002. Cancer Causes Control. 2008;19(4):379-90.
2. Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin. 2013;63(1):11-30.
3. Appelbaum FR, Gundacker H, Head DR, Slovak ML, Willman CL, Godwin JE, et al. Age and acute myeloid leukemia. Blood. 2006;107(9):3481-5.
4. Brasil. Ministério da Saúde. Instituto Nacional do Câncer José Alencar Gomes da Silva. Estimativas 2012: incidência de câncer no Brasil. Rio de Janeiro: INCA; 2011. Disponível em: http://portal.saude.sp.gov.br/resources/ses/perfil/gestor/homepage/estimativas-de-incidencia-de-cancer-2012/estimativas_incidencia_cancer_2012.pdf. Acessado em 2015 (19 out).
5. Linet MS. The leukemias: epidemiologic aspects.New York: Oxford University Press; 1985.
6. Löwenberg B, Downing JR, Burnett A. Acute myeloid leukemia. N Engl J Med. 1999;341(14):1051-62.
7. Vardiman JW, Thiele J, Arber DA, Brunning RD, Borowitz MJ, Porwit A, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood. 2009;114(5):937-51.
8. Grimwade D, Walker H, Oliver F, Wheatley K, Harrison C, Harrison G, et al. The importance of diagnostic cytogenetics on outcome in AML: analysis of 1,612 patients entered into the MRC AML 10 trial. The Medical Research Council Adult and Children’s Leukaemia Working Parties. Blood. 1998;92(7):2322-33.
9. Byrd JC, Mrózek K, Dodge RK, Carroll AJ, Edwards CG, Arthur DC, et al. Pretreatment cytogenetic abnormalities are predictive of induction success, cumulative incidence of relapse, and overall survival in adult patients with de novo acute myeloid leukemia: results from Cancer and Leukemia Group B (CALGB 8461). Blood. 2002;100(13):4325-36.
10. Marcucci G, Mrózek K, Ruppert AS, Archer KJ, Pettenati MJ, Heerema NA, et al. Abnormal cytogenetics at date of morphologic complete remission predicts short overall and disease-free survival, and higher relapse rate in adult acute myeloid leukemia: results from cancer and leukemia group B study 8461. J Clin Oncol. 2004;22(12):2410-8.
11. Yin CC, Medeiros LJ, Bueso-Ramos CE. Recent advances in the diagnosis and classification of myeloid neoplasms--comments on the 2008 WHO classification. Int J Lab Hematol. 2010;32(5):461-76.
12. Kottaridis PD, Gale RE, Frew ME, Harrison G, Langabeer SE, Belton AA,et al. The presence of a FLT3 internal tandem duplication in patients with acute myeloid leukemia (AML) adds important prognostic information to cytogenetic risk group and response to the first cycle of chemotherapy: analysis of 854 patients from the United Kingdom Medical Research Council AML 10 and 12 trials. Blood. 2001;98(6):1752-9.
13. Schnittger S, Schoch C, Dugas M, Kern W, Staib P, Wuchter C,et al. Analysis of FLT3 length mutations in 1003 patients with acute myeloid leukemia: correlation to cytogenetics, FAB subtype, and prognosis in the AMLCG study and usefulness as a marker for the detection of minimal residual disease. Blood. 2002;100(1):59-66
14. Thiede C, Steudel C, Mohr B, Schaich M, Schäkel U, Platzbecker U, et al. Analysis of FLT3-activating mutations in 979 patients with acute myelogenous leukemia: association with FAB subtypes and identification of subgroups with poor prognosis. Blood. 2002;99(12):4326-35.
15. Falini B, Mecucci C, Tiacci E, Alcalay M, Rosati R, Pasqualucci L, et al. Cytoplasmic nucleophosmin in acute myelogenous leukemia with a normal karyotype. N Engl J Med. 2005;352(3):254-66.
16. Marcucci G, Haferlach T, Döhner H. Molecular genetics of adult acute myeloid leukemia: prognostic and therapeutic implications. J Clin Oncol. 2011;29(5):475-86.
17. Döhner H, Estey EH, Amadori S, Appelbaum FR, Büchner T, Burnett AK, et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood. 2010;115(3):453-74.
18. Abdel-Wahab O, Mullally A, Hedvat C, Garcia-Manero G, Patel J, Wadleigh M, et al. Genetic characterization of TET1, TET2, and TET 3 alterations in myeloid malignancies. Blood. 2009;114(1):144-7.
19. Van Vlierberghe P, Patel J, Abdel-Wahab O, Lobry C, Hedvat CV, Balbin M, et al. PHF6 mutations in adult acute myeloid leukemia. Leukemia. 2011;25(1):130-4.
20. Carbuccia N, Murati A, Trouplin V, Brecqueville M, Adélaïde J, Rey J, et al. Mutations of ASXL1 gene in myeloproliferative neoplasms. Leukemia. 2009;23(11):2183-6.
21. Patel JP, Gönen M, Figueroa ME, Fernandez H, Sun Z, Racevskis J, et al. Prognostic relevance of integrated genetic profiling in acute myeloid leukemia. N Engl J Med. 2012;366(12):1079-89.
22. Green CL, Evans CM, Zhao L, Hills RK, Burnett AK, Linch DC,et al. The prognostic significance of IDH2 mutations in AML depends on the location of the mutation. Blood. 2011;118(2):409-12.
23. Shivarov V, Gueorguieva R, Stoimenov A, Tiu R. DNMT3A mutation is a poor prognosis biomarker in AML: results of a meta-analysis of 4500 AML patients. Leuk Res. 2013;37(11):1445-50.
24. Stein EM, Tallman MS. Remission induction in acute myeloid leukemia Int J Hematol. 2012;96(2):164-70.
25. Schlenk RF. Post-remission therapy for acute myeloid leukemia. Haematologica. 2014;99(11):1663-70.
26. Estey EH. Acute myeloid leukemia: 2013 update on risk-stratification and management. Am J Hematol. 2013;88(4):318-27.
27. Pollyea DA, Gutman JA, Gore L, Smith CA, Jordan CT. Targeting acute myeloid leukemia stem cells: a review and principles for the development of clinical trials. Haematologica. 2014;99(8):1277-84.
28. Stein EM, Tallman MS. Novel and emerging drugs for acute myeloid leukemia. Curr Cancer Drug Targets. 2012;12(5):522-30.
29. Tallman MS, Nabhan C, Feusner JH, Rowe JM. Acute promyelocytic leukemia: evolving therapeutic strategies. Blood. 2002;99(3):759-67.
30. Ohno R, Asou N, Ohnishi K. Treatment of acute promyelocytic leukemia: strategy toward further increase of cure rate. Leukemia. 2003;17(8):1454-63.
31. Sanz MA, Martín G, González M, León A, Rayón C, Rivas C, et al. Risk-adapted treatment of acute promyelocytic leukemia with all- trans-retinoic acid and anthracycline monochemotherapy: a multicenter study by the PETHEMA group. Blood. 2004;103(4):1237-43.
32. Lo-Coco F, Avvisati G, Vignetti M, Thiede C, Orlando SM, Iacobelli S, et al. Retinoic acid and arsenic trioxide for acute promyelocytic leukemia. N Engl J Med. 2013;369(2):111-21.
33. Ossenkoppele G, Löwenberg B. How I treat the older patient with acute myeloid leukemia. Blood. 2015;125(5):767-74.
34. Michaelis LC, Erba HP. Recent developments in the treatment of older individuals with acute myeloid leukemia: 2014. Curr Opin Hematol. 2015;22(2):108-15.
35. Kaur I, Constance JE, Kosak KM, Spigarelli MG, Sherwin CM. An extensive pharmacokinetic, metabolic and toxicological review of elderly patients under intensive chemotherapy for acute myeloid leukemia. Expert Opin Drug Metab Toxicol. 2015;11(1):53-65.
36. Walter RB, Estey EH. Management of older or unfit patients with acute myeloid leukemia. Leukemia. 2015;29(4):770-5.
37. Foran JM. Frontline therapy of AML: should the older patient be treated differently? Curr Hematol Malig Rep. 2014;9(2):100-8.
38. Hamerschlak N. Myeloid leukemia: are we getting better? Rev Bras Hematol Hemoter. 2015;37(1):3-4.
39. Ritchie EK, Feldman EJ, Christos PJ, Rohan SD, Lagassa CB, Ippoliti C, et al. Decitabine in patients with newly diagnosed and relapsed acute myeloid leukemia. Leuk Lymphoma. 2013;54(9):2003-7.
40. de Lima M, Couriel D, Thall PF, Wang X, Madden T, Jones R, et al.Once- daily intravenous busulfan and fludarabine: clinical and pharmacokinetic results of a myeloablative, reduced-toxicity conditioning regimen for allogeneic stem cell transplantation in AML and MDS. Blood. 2004;104(3):857-64.
41. Champlin R. Reduced-intensity allogeneic hematopoietic transplantation should be considered a standard of care for older patients with acute myeloid leukemia. Biol Blood Marrow Transplant. 2011;17(12):1723-4.
42. Farag SS, Maharry K, Zhang MJ, Pérez WS, George SL, Mrózek K, et al. Comparison of reduced-intensity hematopoietic cell transplantation with chemotherapy in patients age 60-70 years with acute myelogenous leukemia in first remission. Biol Blood Marrow Transplant. 2011;17(12):1796-803.
43. Capra M, Vilella L, Pereira WV, Coser VM, Fernandes MS, Schilling MA, et al. Estimated number of cases, regional distribution and survival of patients diagnosed with acute myeloid leukemia between 1996 and 2000 in Rio Grande do Sul, Brazil. Leuk Lymphoma. 2007;48(12):2381-6
44. Hamerschlak N, Barton D, Pasquini R, Sarquis YN, Ferreira E, Moreira FR, et al. Estudo retrospectivo do tratamento de leucemia mielóide aguda com o transplante de medula óssea: a experiência brasileira [Retrospective study of stem cell transplantation for acute myeloid leukemia (AML): the Brazilian experience]. Rev Bras Hematol Hemoter. 2006;28(1):11-8.
45. Colturato VAR, Souza MP, Mauad MA, Paton EJA, Pieroni F, Stracieri ABLP, et al. Fludarabina e bussulfan (Flu-Bu): um regime de condicionamento de baixa toxicidade mesmo em uso de bussulfan via oral. A experiência do grupo Cooperativo Conexão Caipira. In: IX Congresso Brasileiro de Transplante de Medula Óssea, Campos do Jordão, 2005;27:33. [abstract].
46. Kerbauy FR, Rodrigues M, de Souza Santos FP, Sobrinho JN, Kutner JM, Torres MA, et al. Allogeneic hematopoietic stem cell transplant after intravenous busulfan and fludarabine conditioning. Leuk Lymphoma. 2011;52(2):321-4.
47. Helman R, Santos FPS, Simões B, Atta EH, Callera F, Dobbin JA, et al. Leucemia mieloide aguda: atualidade brasileira de diagnóstico e tratamento [Acute myeloid leukemia: update in diagnosis and treatment in Brazil]. Einstein (São Paulo). 2011;9(2 Pt 1):179-83.
48. Alatrash G, de Lima M, Hamerschlak N, Pelosini M, Wang X, Xiao L, et al. Myeloablative reduced-toxicity i.v. busulfan-fludarabine and allogeneic hematopoietic stem cell transplant for patients with acute myeloid leukemia or myelodysplastic syndrome in the sixth through eighth decades of life. Biol Blood Marrow Transplant. 2011;17(10):1490-6.
49. Silla LM, Dulley F, Saboya R, Paton E, Kerbauy FR, Arantes AM, et al.. Hematopoietic stem cells transplantation and acute myeloid leukemia: Brazilian guidelines. Rev Bras Hematol Hemoter. 2010;32(suppl 1): 61-5.
50. Hamerschlak N, Bouzas LFS, Seber A, Silla L, Ruiz MA. Diretrizes da Sociedade Brasileira de Transplante de de Medula Óssea 2012. São Paulo; Sociedade Brasileira de Transplante de Medula Óssea, 2013.
51. Rego EM, Kim HT, Ruiz-Argüelles GJ, Undurraga MS, Uriarte Mdel R, Jacomo RH, et al. Improving acute promyelocytic leukemia (APL) outcome in developing countries through networking, results of the International Consortium on APL. Blood. 2013;121(11):1935-43.
52. Silla LMR, Dulley F, Saboya R, Paton E, Kerbauy F, Arantes AM, et al. Bone marrow transplantation and acute myeloid leukemia: Brazilian guidelines. Rev Bras Hematol Hemoter. 2013;35(1):56-61.
53. Esteves I. Avaliação plasmática dos níveis de bussulfano em pacientes submetidos à Transplante de Células Tronco Hematopoiéticas. [Tese]. São Paulo: Universidade Federal de São Paulo; 2014.
54. Hamerschlak N, Pires F, Helman R, Datoguia T, Campregher PV, Oliveira W, et al. Projeto LMA Brasil 2012-2014. São Paulo: Proadi/Ministério da Saude; 2012. Disponível em: http://www.lmabrasil.com.br/. Acessado em 2015 (20 out).
[*]Pasquini M. Resultados de transplantes de medula óssea de centros de transplante brasileiros através dos registros do Center for International Blood and Marrow Transplant Research (CIBMTR). [Apresentação durante o Congresso Brasileiro de Transplantes de Medula Óssea-SBTMO 2007].