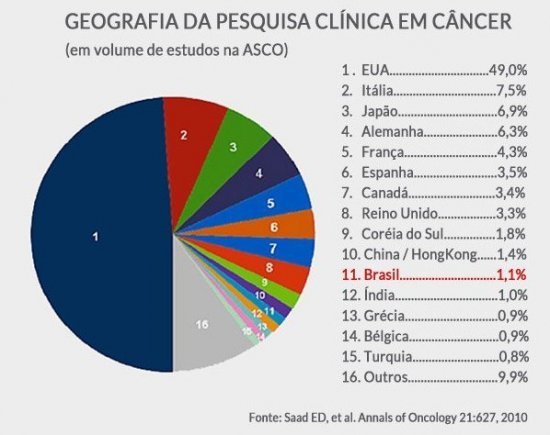
 O oncologista Carlos Barrios, diretor do Instituto do Câncer Mãe de Deus e diretor executivo do Grupo Latino Americano de Pesquisa em Oncologia (LACOG), voltou a criticar os entraves regulatórios e burocráticos que dificultam o setor de pesquisa clínica no Brasil. “Centenas de estudos deixam de ser realizados aqui e os pacientes brasileiros perdem a oportunidade de participar de pesquisas internacionais com medicamentos inovadores. Na outra ponta, perde a comunidade científica, perdem os pesquisadores e o Brasil sai perdendo em capacidade de inovação. Isso precisa mudar”, reforçou Barrios.
O oncologista Carlos Barrios, diretor do Instituto do Câncer Mãe de Deus e diretor executivo do Grupo Latino Americano de Pesquisa em Oncologia (LACOG), voltou a criticar os entraves regulatórios e burocráticos que dificultam o setor de pesquisa clínica no Brasil. “Centenas de estudos deixam de ser realizados aqui e os pacientes brasileiros perdem a oportunidade de participar de pesquisas internacionais com medicamentos inovadores. Na outra ponta, perde a comunidade científica, perdem os pesquisadores e o Brasil sai perdendo em capacidade de inovação. Isso precisa mudar”, reforçou Barrios.
A crítica parece ser uma unanimidade entre os centros de pesquisa no Brasil e a própria Sociedade Brasileira dos Profissionais de Pesquisa Clínica (SBPPC) há tempos chama a atenção para o problema. O debate se arrasta na Agência Nacional de Vigilância Sanitária (Anvisa), no Conselho Nacional de Saúde (CNS) e já chegou até ao Senado, pela Comissão de Assuntos Sociais, através da senadora gaucha Ana Amélia Lemos. No entanto, nenhuma solução propositiva foi apresentada até agora para mudar o cenário da pesquisa clínica no país.
No último dia 9/10, o diretor presidente da Anvisa, Dirceu Barbano, falou sobre as novas regras em pronunciamento transmitido via internet, mas apesar da expectativa a agência não publicou ainda o texto final que atualiza a RDC 39 de 2008. A Resolução da Diretoria Colegiada passa a fixar uma nova moldura regulatória para a pesquisa clínica brasileira e o registro de medicamentos. O documento foi objeto da consulta pública nº 65, apresentada no dia 4 de agosto, que durante 30 dias recebeu críticas e comentários. Incluiu desde normas de registro para comprovação de eficácia e segurança, até aspectos relacionados ao monitoramento das Boas Práticas Clínicas.
“Uma das críticas mais importantes era em relação aos prazos e a proposta da Anvisa agora é permitir o início da pesquisa em até 90 ou 120 dias caso a agência não se manifeste. No entanto, se a Anvisa se manifestar depois desse prazo de forma contrária, o grupo de pesquisa terá que se adequar às exigências ou interromper seu trabalho”, ilustra Greyce Lousana, presidente da SBPPC e membro da comissão executiva do Fórum Permanente dos Comitês de Ética e Profissionais de Pesquisa (FOCEP).
A especialista explica que a norma vai retroagir. “Logo, o que está na fila também terá que se adaptar às novas regras. Essas são apenas algumas das mudanças”, ilustra. “Tivemos avanços importantes, mas ainda com pontos que precisam ser avaliados”, esclarece. Entre o setor regulado, sobram queixas sobre a atuação da Anvisa no que se refere ao registro de medicamentos e à regulação da pesquisa clínica. A valorização de desfechos duros, que deixa de considerar a perspectiva da qualidade de vida, é um aspecto recorrente, assim como a falta de critérios, já comparada a uma “crazy regulation”.
Reações contrárias à Anvisa ganharam relevo no episódio lenalidomida, agente empregado no tratamento do mieloma múltiplo em mais de 80 países, que por duas vezes teve seu registro negado no Brasil. O crizotinibe, para câncer de pulmão com rearranjo ALK, enfrentou problema semelhante. Depois de aprovado em 74 países, teve o pedido de registro indeferido pela agência brasileira, assim como outros agentes para o tratamento de tumores sólidos e neoplasias hematológicas.
Outras drogas aguardam longos períodos de análise, casos como a enzalutamida para o câncer de próstata resistente a castração, e enquanto isso médicos e pacientes brasileiros deixam de ter acesso a tratamentos que têm reformulado o panorama da oncologia.
“Acaso as agências internacionais, como FDA e EMA são menos éticas?”, questiona Barrios.
O diretor da Anvisa, Renato Porto, se comprometeu com mudanças. “Queremos nos alinhar ao que já é praticado por agências como FDA e EMA”, disse Porto. O que se espera é que esse novo marco regulatório de pesquisa clínica de fato aproxime o Brasil e a Anvisa das melhores metodologias”.
O histórico das recentes decisões da agência e questões práticas, como o reduzido quadro de servidores, põem em dúvida a capacidade da Anvisa de efetivar as propostas.
Dupla análise
Além da instância reguladora, a pesquisa clínica também está vinculada ao sistema de avaliação ética, o sistema CEP/CONEP, instituído pelo Conselho Nacional de Saúde, em um modelo que também acumula queixas da comunidade de pesquisa clínica. “A relação entre a Comissão Nacional de Ética em Pesquisa (Conep) e os Comitês de Ética em Pesquisa (CEPs) precisa ser revista para promover maior independência dos CEPs. Essa dupla análise é um fator que compromete a liberação de pesquisas que incluem novas tecnologias”, diz Greyce Lousana.
O descontentamento é antigo. Começou com a revisão da Resolução 196, marco que instituiu no Brasil a primeira moldura de bioética. A revisão, ao invés de aprimorar e atualizar os preceitos criados no final dos anos 90, acabou sob a crítica de engessar a pesquisa brasileira, coibir a presença de centros estrangeiros e superproteger o paciente, que de tão blindado acabou excluído dos estudos multicêntricos internacionais. Há dois anos, o que deveria ser finalmente a modernização do panorama regulatório, de novo decepcionou a comunidade de pesquisa clínica. A Resolução 466, publicada em 2012 pelo Conselho Nacional de Saúde, provocou reações de vários setores, da comunidade médico-científica até as organizações de pacientes.
O médico Carlos Barrios compara os prazos de análise em regiões como Europa e Estados Unidos e explica porque o paciente brasileiro acaba alijado da participação em estudos clínicos multicêntricos internacionais. “Lá, é possível obter uma aprovação em torno de 90 dias. No Brasil, a espera é de até 14 meses”, contrasta. “Vários centros de pesquisa inscrevem seus pacientes para participar e lamentavelmente nós ficamos de fora. Muitas vezes, o estudo se encerra antes da burocracia dos órgaos brasileiros”.
O coordenador da Comissão Nacional de Ética em Pesquisa (CONEP/CNS), Jorge Venâncio, convocou 30 membros ad hoc para acabar com as filas, reduziu os prazos de análise, mas a iniciativa está longe de trazer respostas concretas a toda a extensão do problema, a começar pela falta de diálogo entre o sistema CEP/CONEP.
E os entraves vão além. A Plataforma Brasil, um sistema de informação criado com a proposta de acompanhar a pesquisa clínica brasileira, na prática é um gargalo a mais. Depois de mais de 20 versões diferentes do sistema, a versão definitiva é prometida para fevereiro de 2015. Na opinião do FOCEP, a Plataforma Brasil não conseguiu atingir seus reais objetivos dois anos depois de sua implementação, não serve como base de dados eficiente para a busca de projetos, nem traz respostas às demandas dos relatores dos CEPs e pesquisadores. “A Plataforma Brasil não funciona como um canal de comunicação entre os envolvidos em uma pesquisa, não atende às necessidades apresentadas ao longo de uma pesquisa, não contempla todos os tipos de pesquisas desenvolvidas no país, além de possuir importantes inconsistências entre seu sistema tecnológico e as normas vigentes”, diz a comissão executiva.
Alerta
O diretor do LACOG realiza na terça-feira, 14/10, encontro com Martine Piccart-Gebhart e Fabrice André, do Instituto Gustave Roussy, ambos pesquisadores do Breast International Group (BIG). “Queremos discutir alternativas em conjunto com investigadores de grupos latino-americanos de pesquisa para enfrentar o crescente problema do câncer na América Latina”, diz Barrios. “Uma das alternativas para enfrentar esse aumento dramático no número de casos de câncer é a pesquisa clínica”, explica.
A transição epidemiológica deve certamente impactar as taxas de mortalidade por doenças crônico-degenerativas, entre elas o câncer. Alerta dado em 2005 pela UICC, a União Internacional para o Controle do Câncer, previa o câncer como primeira causa de mortalidade em 2020, superando as doenças cardiovasculares em países como o Brasil. Artigo publicado no The Lancet Oncology em 2013 estima que 1,7 milhão de novos casos serão diagnosticados em 2030 na América Latina.
Nesse cenário, crescem também as iniquidades no acesso às melhores práticas de prevenção, diagnóstico e tratamento. Dados do GLOBOCAN e da Organização Mundial de Saúde (OMS) mostram que África, Ásia, América Central e do Sul respondem por 70% das mortes por câncer no mundo.
Para Barrios, o tratamento dispensado às mulheres com câncer de mama HER2 positivo atendidas pelo sistema público é emblemático das iniquidades na saúde. “O trastuzumabe, por exemplo, chegou com anos de atraso em relação à saúde suplementar e até hoje não está disponível para a doença metastática. É fazer as contas e ver que isso custou a vida de milhares de mulheres”.
|
Câncer de Mama: Número de casos/ano |
57.120 |
|---|---|
|
Casos atendidos pelo SUS (73.7%) - sem cobertura pela saúde suplementar |
42.097 |
|
Pacientes estágios I/II/III (94%) |
39.571 |
|
Pacientes SUS HER2 positivas (20%) |
7.914 |
|
Mortes evitadas por Trastuzumabe / ano (9%) |
712 |
|
Mortes de mulheres HER2 positivas (SUS) - (2005-2012) - assume número constante de incidência e mortalidade. |
5.696 |
Fonte: INCA / IBGE








