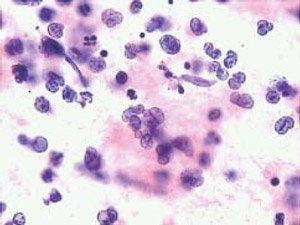
 O FDA concedeu aprovação acelerada para o agente belinostat, indicado para o tratamento de pacientes com linfoma periférico de células T em recidiva ou com doença refratária. A aprovação foi baseada nos resultados do estudo multicêntrico que investigou 120 pacientes com LPCT refratário ou que recaíram após tratamento prévio. O objetivo primário do estudo foi a taxa de resposta global (TRG), avaliada por um comitê de revisão independente.
O FDA concedeu aprovação acelerada para o agente belinostat, indicado para o tratamento de pacientes com linfoma periférico de células T em recidiva ou com doença refratária. A aprovação foi baseada nos resultados do estudo multicêntrico que investigou 120 pacientes com LPCT refratário ou que recaíram após tratamento prévio. O objetivo primário do estudo foi a taxa de resposta global (TRG), avaliada por um comitê de revisão independente.
Belinostat foi administrado por infusão intravenosa a uma dose de 1000 mg/m2, uma vez por dia nos dias 1-5 de um ciclo de 21 dias. Foram considerados elegíveis os pacientes com plaquetas de base <100.000 / microlitros. A análise aponta TRG de 25,8% (IC 95%: 18,3, 34,6). As taxas de resposta completa e parcial foram de 10,8% e 15,0%, respectivamente. A duração da resposta mediana entre a primeira data de resposta a progressão da doença ou morte foi de 8,4 meses (IC 95%: 4,5-29,4).
As reações adversas mais comuns (> 25%) na população de segurança (N = 129) foram náuseas, fadiga, febre, anemia e vômitos. As reações mais graves foram relatadas em 47% dos pacientes e incluíram trombocitopenia grau 3 ou 4, infecções, anemia, aumento da creatinina, e insuficiência de múltiplos órgãos. Uma morte relacionada com o tratamento devido a insuficiência hepática foi relatada.
Agora, em cumprimento às condições do FDA para a aprovação acelerada, o patrocinador deve realizar um ensaio de determinação da dose de belinostat quando combinado com CHOP (ciclofosfamida, vincristina, doxorrubicina e prednisona) e um posterior ensaio de fase 3 para caracterizar a eficácia e a segurança do belinostat em combinação com o esquema CHOP.
A dose recomendada eo cronograma para belinostat é de 1.000 mg/m2, administrada ao longo de 30 minutos de infusão intravenosa, uma vez por dia nos dias 1-5 a cada 3 semanas.
Os profissionais de saúde devem relatar todos os eventos adversos graves suspeitas de estarem associados com o uso de qualquer medicamento e dispositivo para MedWatch Reporting System do FDA através do preenchimento de um formulário on-line, ou enviando o formulário de endereço porte-pago fornecido on-line ou por telefone (1-800 - FDA-1088).
Fonte: FDA