 O primeiro anticorpo monoclonal produzido no Brasil ilustra uma política que promete a expansão do acesso, com uma economia anual de US$ 1 bilhão por ano na balança de medicamentos
O primeiro anticorpo monoclonal produzido no Brasil ilustra uma política que promete a expansão do acesso, com uma economia anual de US$ 1 bilhão por ano na balança de medicamentos
Grandes centros de câncer participam dos primeiros estudos clínicos com anticorpos monoclonais de produção nacional, o que mostra que os biossimilares já são uma realidade por aqui.
A aposta é o rebmab100, o primeiro anticorpo monoclonal produzido no Brasil, agora em estudo de fase II em câncer de mama avançado, depois de um ensaio clínico em tumores de ovário. O ICESP é o centro coordenador e instituições como o Hospital de Câncer de Barretos e o INCA participam dos testes clínicos – os primeiros com registro na Anvisa e no FDA. A partir dos resultados iniciais, o remab100 já obteve do Food and Drug Administration (FDA) a designação de Droga Órfã para o tratamento do câncer de ovário.
“Temos um biobetter”, avisa José Fernando Perez, diretor-presidente e idealizador da Recepta Biopharma, responsável pela molécula registrada sob o código Hu3S193 na plataforma clinical trials.
No momento em que as biofarmacêuticas brasileiras guardam a sete chaves suas estratégias de negócios, a Recepta Biopharma foge à regra e fala com tranquilidade sobre seu modelo de atuação e seus planos de investimento. A empresa não está preocupada com o ciclo produtivo das novas drogas biossimilares, mas sim com o objetivo de desenvolver e vender aqui os mABs de última geração.
Perez é professor aposentado do Instituto de Física da USP e esteve à frente do programa Genoma, no ano 2000. “Foi um sucesso inacreditável, com uma repercussão muito grande”, recorda. “Saiu artigo no The Economist, uma fotografia minha desse tamanho no New York Times, uma loucura! E o mundo inteiro se surpreendeu com a ciência que a gente fazia aqui”, diz ele. Agora, está disposto a repetir a dose. Trocou uma aposentadoria na Fapesp pela aliança com o prestigiado Instituto Ludwig, que além de 30% de participação na Recepta ainda trouxe para a operação o apoio científico da suíca 4-Antibody AG, que fornece a plataforma tecnológica para gerar os anticorpos.
O passo seguinte foi se valer do network dos tempos do Genoma e buscar apoio de gente grande para viabilizar a companhia. De cara, Perez captou Emilio Odebrecht e Jovelino Carvalho Mineiro Filho, além de um aporte de R$ 30 milhões do BNDES.
“Essa empresa tem uma agenda Brasil e um DNA brasileiro, de pessoas que acreditam que esse avanço é possível e necessário”, diz.
Desafios e Regulação
O clima de otimismo verde-amarelo não encobre os desafios que batem à porta da nascente biotecnologia brasileira diante dos biossimilares. Um deles vem da própria complexidade do processo de desenvolvimento. Os biossimilares são moléculas de alto peso molecular, fabricadas a partir de células vivas que não podem ser replicadas através de síntese química ou físico-química. É de se imaginar um mundo de diferença entre os 21 átomos que compõem a aspirina e os mais de 20 mil átomos da fórmula original do herceptin, um dos ícones da geração de biológicos. E se são tão complexas e potencialmente tão imunogênicas, o raciocínio aponta, de um lado, para o desafio envolvido no processo – da P&D à produção – e de outro, expõe a importância de uma regulação capaz de assegurar eficácia, segurança e qualidade.
No Brasil, cópias de eritropoetinas recombinantes foram aprovadas com base em um estudo aberto com amostra de 25 pacientes em fase 1–2a, realizado por Bio-Manguinhos, da Fundação Oswaldo Cruz. Hoje, um desenho desses seria inviável para qualificar um agente biológico em estudo de fase clínica.
Os produtos biológicos e biossimilares foram tema da Resolução WHA 67.21, publicada no final de maio pela Organização Mundial de Saúde (OMS). O documento, saldo da 67ª assembléia mundial da OMS, apelou aos estados-membros para desenvolver ou reforçar os quadros nacionais de avaliação regulatória para atender às necessidades dos agentes biológicos e biossimilares “dentro de marcos regulatórios sólidos e apoiados em base científica”.
“A chamada etapa 1 da ANVISA, que foi escrever as resoluções e desenhar o marco regulatório, está praticamente cumprida. Agora é que começa a etapa dois, dar vida às RDCs, fazer com que aquilo que está no texto possa ser encontrado na vida real”, diz Antonio Britto, presidente-executivo da Interfarma. “A resolução da ANVISA faz sérias exigências sobre as boas práticas de fabricação de medicamentos, mas somos muito frágeis em farmacovigilância. Não podemos garantir que aquilo que está saindo de algumas plantas é exatamente aquilo que foi desenhado. Não podemos nos acomodar com um Brasil que é sanitariamente bom no papel, mas precisamos garantir um Brasil sanitariamente bom também na vida real”, diz ele.
E os planos das “superfarmacêuticas” nacionais, assustam a indústria?
“Não importa a pretensão dos players. O que vai definir o futuro é saber se eles vão investir pesadamente em pesquisa e ter compromisso com a inovação ou se serão muito mais empresas de trading que recebem tecnologia de fora, empacotam e vendem aqui”, diz Britto.
O preço da inovação
A próxima onda chegou e os biossimilares já aterrissaram por aqui. Não é difícil compreender o desejo do Ministério da Saúde de investir na produção nacional. O Brasil é o 7º maior consumidor de medicamentos do mundo e o Sistema Único de Saúde (SUS) é de longe o maior comprador. Com os biossimilares, a economia esperada chega a US$ 1 bilhão por ano.
A oncologia é uma das áreas da medicina que mais sofre o impacto das drogas biológicas e ninguém tem dúvida de que o preço de tanta inovação afeta os sistemas de saúde de todo o mundo. Até mesmo o abastado modelo americano começa a reclamar do impacto dos modernos antineoplásicos na balança comercial.
Dados do National Comprehensive Cancer Network (NCCN) e da American Journal of Health System Pharmaceuticals mostram que em 2010 a compra de drogas biológicas nos EUA representou 60% de todo o desembolso com prescrições. Por aqui, o impacto também é grande - e nosso orçamento à saúde é muitas vezes menor. Em 2012, o déficit brasileiro na balança comercial de medicamentos atingiu US$ 11 bilhões. Atualmente, os biológicos consomem 43% dos custos com medicamentos na saúde pública: são R$ 4 bilhões por ano para adquirir o que equivale a apenas 5% de toda a cesta do SUS.
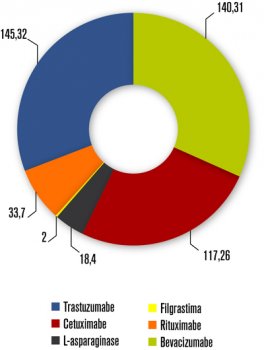 Os top 10
Os top 10
Muitos agentes da primeira safra dos anticorpos monoclonais (mABs) estão prestes a perder a patente ou já vivem sem a proteção patentária. São esses “mABs “ os primeiros a chegar em versão biossimilar com produção nacional. É o caso de agentes como bevacizumabe, rituximabe, trastuzumabe e cetuximabe, que figuram entre os “top 10” como os mais usados na oncologia.
O Ministério da Saúde estimulou o processo de nacionalização da biotecnologia com os modelos de Parceria para o Desenvolvimento Produtivo (PDPs). Em junho de 2013, 27 PDPs foram lançadas, de olho na produção de 14 agentes biológicos, incluindo os antineoplásicos. A proposta é incentivar alianças entre 17 laboratórios privados e oito laboratórios públicos.
Foi como saldo dessa política que o governo captou o apoio da Merck Serono na parceria com a Bionovis, Fiocruz e Instituto Vital Brasil (IVB) para viabilizar a produção de seis medicamentos biológicos – etanercepte, rituximabe, bevacizumabe, cetuximabe, infliximabe e trastuzumabe.
“A garantia da compra dos medicamentos por cinco anos é o maior incentivo”, diz Vera Valente, gerente geral da Merck. “O governo é praticamente o comprador exclusivo e deu um recado muito claro: ‘produza e transfira sua tecnologia. Você vai ter em troca uma estabilidade na compra desses produtos ao longo de cinco anos’. isso foi sem dúvida um grande incentivo”, reforça.
As biofarmacêuticas
A Bionovis é resultado da aliança entre quatro laboratórios com presença na produção de genéricos (Aché, EMS, União Química e Hypermarcas). Anunciada em março de 2012 como a “superfarmacêutica”, a companhia celebra a parceria com a Merck, que assegurou o domínio de todo o ciclo de desenvolvimento.
“Temos o conhecimento completo dessa tecnologia de biológicos, desde P&D até a manufatura”, diz a gerente da Merck.
A Orygen Biotecnologia é outra superfarmacêutica interessada nos biológicos e biossimilares. Nasceu em 2012 da aliança entre Biolab, Cristália, Eurofarma e Libbs, mas de lá para cá a estabilidade da empresa ficou na berlinda. Primeiro, perdeu a Libbs; mais recentemente, a Cristália, que também optou pela carreira solo. Será que a Orygen começou com o pé esquerdo?
Quem responde é o bioquímico inglês, Andrew Simpson, que durante anos foi diretor científico do Instituto Ludwig e em 2013 assumiu o comando da superfarmacêutica brasileira. “Por afinidade de estratégias, ficou mais natural que Biolab e Eurofarma seguissem juntas e, por estratégias diferentes, Libbs e Cristália optaram por outro caminho, mas em termos de objetivo isso não mudou em nada o negócio da Orygen”, garante.
A companhia planeja investimentos de 500 milhões de reais em 5 anos e espera produzir os primeiros agentes a partir de 2018.
“Estamos com planos de produzir cinco anticorpos monoclonais, três deles empregados no tratamento do câncer, trastuzumabe, bevacizumabe e rituximabe. A estratégia é fazer uma parceria no exterior, para a transferência de tecnologia”, diz ele, que não confirma as especulações em torno da aliança com a suíça Epirus, como divulgado por periódicos internacionais.
“O acesso ao mercado público é uma vantagem que outras companhias de biológicos e biossimilares não terão no futuro, apenas aquelas que participam das PDPs”, lembra Simpson.
O Grupo FarmaBrasil, que representa os interesses das farmacêuticas de capital nacional, reforça o coro dos otimistas.“Uma parte do know-how já existe para os biológicos de primeira geração e agora iniciamos a internacionalização de tecnologias para essa fase 2”, diz Reginaldo Arcuri, presidente-executivo do FarmaBrasil. “O Brasil vai ser um novo pólo de tecnologia”, sinaliza.” Nossa aposta e nossa proposta para o governo é fazer do setor de fármacos e medicamentos no Brasil uma indústria de classe mundial”.








