 No final de abril, o registro do primeiro biossimilar do mercado nacional, o Remsima® (infliximabe), reacendeu o debate. Os biossimilares chegam com a promessa de expandir acesso, com custos mais sustentáveis. O ‘x’ da questão é cumprir o desafio de assegurar eficácia, segurança e qualidade, o que faz oscilar a visão sobre a bioindústria farmacêutica brasileira entre a expectativa e o ceticismo.
No final de abril, o registro do primeiro biossimilar do mercado nacional, o Remsima® (infliximabe), reacendeu o debate. Os biossimilares chegam com a promessa de expandir acesso, com custos mais sustentáveis. O ‘x’ da questão é cumprir o desafio de assegurar eficácia, segurança e qualidade, o que faz oscilar a visão sobre a bioindústria farmacêutica brasileira entre a expectativa e o ceticismo.
{jathumbnail off}Há espaço para celebrar mais equilíbrio na balança comercial brasileira, mas também existe espaço para um consenso mundial que alerta sobre a necessidade de critérios mais rigorosos sobre a regulação biológica e clínica dessa geração de medicamentos. No caso da oncologia, os anticorpos monoclonais rituximabe (Rituxan® ou Mabthera®), bevacizumabe (Avastin®), trastuzumabe (Herceptin®) e cetuximabe (Erbitux®) são alguns dos que chegam em breve em versões biossimilares para o tratamento de diferentes tipos de câncer.
O infliximabe, recém aprovado pela Anvisa, não é um medicamento oncológico, mas chega como um bom exemplo da polêmica que ainda cerca a regulamentação brasileira. A molécula foi originalmente desenvolvida pela Janssen, com o nome comercial de Remicade®. Em setembro de 2013, o infliximab teve seu primeiro biossimilar aprovado na Europa, o Remsima®, desenvolvido pela sul-coreana Celltrion. O registro extrapolou as indicações terapêuticas validadas por ensaios clínicos, o que alimentou duras críticas sobre a flexibilização da regulação europeia para além das evidências disponíveis. A Celltrion apresentou resultados de eficácia e segurança para artrite reumatoide e estudo de farmacocinética em espondilite anquilosante. Recebeu autorização para um leque de outras indicações, inclusive doença de Crohn e artrite psoriática.
No episódio da aprovação do infliximab, a Anvisa repetiu o modelo. “A Anvisa criou essa extrapolação para todas as indicações aprovadas para o agente de referência”, critica Denizar Vianna, professor da Universidade Estadual do Rio de Janeiro e membro do Centro Latino-Americano de Pesquisa em Biológicos (CLAPBio). “É uma flexibilização perigosa, que contraria os critérios da OMS e até as normas da própria Anvisa”, diz. O especialista explica que a regulação prevê estudos clínicos randomizados para avaliar um modelo de doença sensível, em uma população sensível. “A artrite reumatóide éo menos sensível dos modelos das doenças inflamatórias reumatológicase, portanto, não poderia embasar essa extrapolação. As pressões orçamentárias estão falando mais alto”, avalia.
A Gerência de Produtos Biológicos (GPBIO) da Anvisa esclarece que o primeiro biológico foi registrado no Brasil pela via da comparabilidade, “após diversas exigências e análise técnica detalhada de todos os estudos necessários para demonstração da qualidade, segurança e eficácia”. A GPBIO acrescenta que “os dados comparativos de qualidade, do perfil farmacocinético e farmacodinâmico, assim como os dados sobre a eficácia e segurança obtidos durante o desenvolvimento clínico, foram suficientes para a aprovação de todas as indicações terapêuticas pleiteadas pela empresa”.
A CLAPBio contesta.”O mecanismo de ação do anticorpo não é o mesmo na doença de Crohn e na artrite reumatóide, o que é fartamente descrito na literatura”, rebate Vianna.
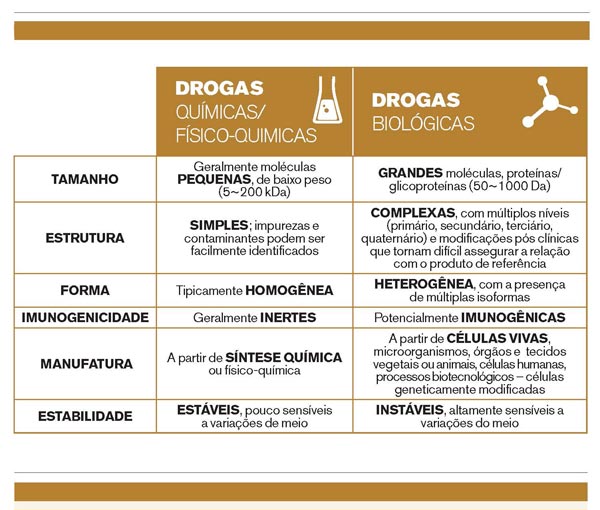
Critérios
Outra polêmica cerca o artigo 26 (RDC 55/2010), que prevê uma via alternativa de registro. É a via de desenvolvimento individual,utilizada nos casos em que o exercício de comparabilidade não pode ser executado devido às características da molécula. No entanto, a Anvisa explica que mesmo nessas situações é preciso conduzir estudos clínicos comparativos.
Para o especialista da CLAPBio, ao prever uma via alternativa de aprovação de medicamentos biológicos sem estudos de comparabilidade, a Anvisa abre um precedente perigoso. “As regras não estão claras”, diz Vianna. “Por que então não adotar uma única via de análise e deixar mais evidente a necessidade de comparar propriedades fisicoquímicas, dados pré-clínicos e clínicos, cabeça a cabeça com o produto de referência?”, indaga. São questões como essas que alimentam a preocupação do setor e sinalizam a importância de reforçar também o olhar sobre a vigilância. “Existem preocupações além da intercambialidade”, alerta Ricardo Garcia, também da CLAPBio. “A substituição do medicamento de referência pelo biológico vai ser feita de forma automática, sem que o médico esteja envolvido e que o sistema esteja organizado para rastrear esse medicamento. Isso impacta a vigilância”, avalia. “É uma discussão crítica educar o prescritor e fortalecer a cultura da vigilância farmacêutica”, recomenda.
Leia Mais: CEO da Orygen prevê redução de até 50% no preço
O que esperar dos biológicos
O mapa das PDPs








