A chegada de abemaciclibe (Verzenius™, Eli Lilly) inaugura um novo capítulo no tratamento do câncer de mama avançado receptor hormonal positivo (RH+), HER2 negativo (HER2-), com taxas de resposta significativamente superiores comparadas ao tratamento endócrino isolado. Dados do perfil de segurança mostram que é possível gerenciar os eventos mais frequentes e relatórios de qualidade de vida sustentam o benefício de abemaciclibe, com evidências para guiar decisões de tratamento.1-5
Pacientes com câncer de mama RH+ HER2- recebem terapia endócrina como padrão de tratamento, mas inúmeras pesquisas procuram identificar agentes capazes de superar a resistência intrínseca ou adquirida a essas terapias. A chegada de abemaciclibe traz novas perspectivas para médicos e pacientes, mostrando benefício de sobrevida, com perfil de segurança manejável.6
Os primeiros dados de eficácia e segurança vieram do estudo MONARCH 2 (NCT02107703), ensaio randomizado, duplo-cego de Fase III que inscreveu 669 pacientes para avaliar abemaciclibe mais fulvestranto. O estudo demonstrou benefício significativo de sobrevida livre de progressão (hazard ratio, 0.553 95% CI, 0.449-0.681; P < 0,0001) em mulheres com câncer de mama avançado HR+ HER2- que progrediram dentro de 12 meses da terapia endócrina anterior, ou como tratamento de segunda linha em pacientes com doença metastática que receberam terapia endócrina na primeira linha. Nessa população, a mediana de SLP foi de 16,4 meses versus 9,3 meses.1
A chegada de abemaciclibe (Verzenius™, Eli Lilly) inaugura um novo capítulo no tratamento do câncer de mama avançado receptor hormonal positivo (RH+), HER2 negativo (HER2-), com taxas de resposta significativamente superiores comparadas ao tratamento endócrino isolado. Dados do perfil de segurança mostram que é possível gerenciar os eventos mais frequentes e relatórios de qualidade de vida sustentam o benefício de abemaciclibe, com evidências para guiar decisões de tratamento.1-5
Pacientes com câncer de mama RH+ HER2- recebem terapia endócrina como padrão de tratamento, mas inúmeras pesquisas procuram identificar agentes capazes de superar a resistência intrínseca ou adquirida a essas terapias. A chegada de abemaciclibe traz novas perspectivas para médicos e pacientes, mostrando benefício de sobrevida, com perfil de segurança manejável.6
Os primeiros dados de eficácia e segurança vieram do estudo MONARCH 2 (NCT02107703), ensaio randomizado, duplo-cego de Fase III que inscreveu 669 pacientes para avaliar abemaciclibe mais fulvestranto. O estudo demonstrou benefício significativo de sobrevida livre de progressão (hazard ratio, 0.553 95% CI, 0.449-0.681; P < 0,0001) em mulheres com câncer de mama avançado HR+ HER2- que progrediram dentro de 12 meses da terapia endócrina anterior, ou como tratamento de segunda linha em pacientes com doença metastática que receberam terapia endócrina na primeira linha. Nessa população, a mediana de SLP foi de 16,4 meses versus 9,3 meses.1
Os resultados foram reportados por Sledge et al. no Journal of Clinical Oncology (2017)1 e atualizados no Jama Oncology2 em um seguimento mediano de 47,7 meses, demonstrando aumento estatisticamente significativo de sobrevida global com abemaciclibe (HR, 0,757; IC: 95%, 0,606-0,945; P = 0,01), com ganho mediano de 9,4 meses (46,7 meses versus 37,3 meses) nessa população de pacientes. O benefício foi consistente em todos os subgrupos e a análise pelo status menopausal indicou resultados de SG tanto na pré ou peri-menopausa (HR, 0,689; IC: 95%, 0,379-1,252), quanto em mulheres na pós-menopausa (HR, 0,773; IC: 95%, 0,609-0,980). A atualização do Jama Oncology também demostrou uma mediana de SLP de 16,9 meses versus 9,3 meses, com taxa de SLP em 3 anos de 29,9% com abemaciclibe contra 10,1% no braço placebo2.
No MONARCH 3 (NCT02246621), abemaciclibe voltou a demonstrar SLP significativamente superior (HR:0,54; IC: 95%, 0,41–0,72; p <0,001), desta vez combinado a um inibidor de aromatase não esteroidal. Neste ensaio clínico de Fase III, duplo-cego e controlado por placebo, foram elegíveis 493 mulheres na pós-menopausa com câncer de mama avançado HR+ HER2− que não receberam tratamento sistêmico prévio no cenário avançado. As pacientes foram randomizadas 2:1 para 150 mg de abemaciclibe duas vezes ao dia ou placebo, combinado a 1 mg de anastrozol ou 2,5 mg de letrozol por escolha do médico3.
Os dados finais reportados por Johnston et al. (Nature, 2019) mostram que abemaciclibe duplicou a SLP na comparação com placebo (28,18 versus 14,76 meses. HR: 0.540 IC: 95%, 0,41–0,69; p = .000002). Neste acompanhamento mais prolongado, após 240 eventos, a ORR foi de 61.0% no braço de abemaciclibe versus 45.5% no braço placebo.4
Abemaciclib in Metastatic Breast Cancer HR+/HER2- (Phase III)
|
MONARCH 3 (N=493)3 |
MONARCH 2 (N=669)2 |
|
|
Treatment |
Abema + NSAI vs NSAI |
Abema + fulvestrant vs fulvestrant |
|
Setting |
1st line MBC |
≥1st line MBC |
|
PFS HR (95% CI) |
0.54 (0.41-0.72) 28.1 vs. 14.7 mos |
0.55 (0.45-0.68) 16.4 vs. 9.3 mos |
|
OS HR (95% CI) |
NM |
0.76 (0.61-0.95) 46.7 vs. 37.3 mos (9.4) |
Dor e qualidade de vida global
Resultados de qualidade de vida relatados pelos próprios pacientes dimensionam o impacto de abemaciclibe no controle de dor e na saúde global (QVRS - Qualidade de Vida Relacionada à Saúde). Melhorar o prognóstico no cenário da doença avançada significa também manter a qualidade de vida, como sustentam recomendações dos principais guidelines.5
Três métodos foram utilizados no ensaio MONARCH 2 para aferir a dor: uma versão abreviada do inquérito Brief Pain modificado (mBPI-sf); o questionário da Organização Europeia para Pesquisa e Tratamento de Câncer (EORTC QLQ-C30), utilizado para avaliar outras dimensões da dor, além da análise que quantificou e categorizou o uso de analgésicos, conforme tipo e frequência.5
|
Menos de 3% |
Os resultados foram reportados por Kaufman, Toi, Neven et al. em artigo no The Oncologist e mostram que os escores de dor com base no mBPI-sf e no EORTC QLQ-C30 foram semelhantes entre o braço abemaciclibe e o braço controle, assim como o uso de analgésicos em qualquer etapa do estudo (36,1% vs 33,2%). Em relação ao uso de opioides, também não foram observadas diferenças no uso de oxycodona (9.5% abemaciclibe vs 9.4% controle) e morfina (5.7% vs 7.2%) entre os braços de análise5.
“A dor é um sintoma comumente relatado como o mais significativo entre pacientes com câncer de mama avançado e demonstrou ser forte preditor da QVRS geral”, destacam os autores. Outro importante indicador de qualidade de vida, o tempo para deterioração sustentada (TTST, da sigla em inglês), novamente mostrou benefício de abemaciclibe (HR: 0.76; IC:95%, 0.59–0.98) em todos os domínios avaliados, incluindo fadiga, náusea e vômitos, além de fatores cognitivos e sociais.5
Analisados em conjunto, esses resultados demonstram que, apesar do aumento da toxicidade associada à adição de abemaciclibe ao tratamento com fulvestranto, houve tolerabilidade ao longo do curso terapêutico, reforçando a noção de que após a toxicidade inicial, os pacientes experimentam um período sustentado de qualidade de vida. A duração do tratamento reflete essa tendência, mostrando que 28,6% dos pacientes no braço abemaciclibe avaliados no MONARCH2 mantiveram tratamento ativo por 2 anos ou mais (26 ciclos), contra 14,8% no grupo placebo. A análise de Sledge et al. mostrou que também o tempo para a segunda progressão (SLP2) melhorou com a adição de abemaciclibe a fulvestranto, com mediana de 23,1 meses contra 20,6 meses no braço controle (HR, 0,675; IC al 95% 0,558-0,816).2
“Dada a natureza paliativa dos cuidados no cenário do câncer de mama avançado, preservar e manter a QVRS e aliviar os sintomas são objetivos primários do tratamento”, reforçam Kaufman e colegas.5
Perfil de segurança
O perfil de segurança de abemaciclibe foi consistente nos ensaios MONARCH 2 e 3 e o evento adverso mais frequente foi diarreia, mais comumente graus 1 e 2. Quando considerados os eventos adversos de grau ≥3, a neutropenia foi a ocorrência mais frequente, normalmente nos primeiros dois ciclos, como sustenta a base de evidências.6
Análise de Rugo et al. discutiu os eventos adversos mais comuns com abemaciclibe e estratégias de manejo. Os resultados reportados (The Oncologist, 2021;26:e53–e65) mostram que diarreia clinicamente significativa (grau ≥2) ocorreu em 42,8% dos pacientes, especialmente no ciclo inicial. No entanto, a diarreia foi adequadamente manejada com medicação antidiarreica (72,8%), omissões de dose (17,3%) ou reduções (16,7%)6.
Para o manejo da ocorrência de diarreia, os pacientes foram aconselhados a tomar a medicação prescrita ao primeiro sintoma, incluindo antidiarreicos de venda livre, como a loperamida. Caso o problema persistisse dentro de 24 horas, ajustes de dose eram recomendados, conforme o protocolo do estudo. As recomendações específicas incluíram a suspensão de abemaciclibe na primeira ocorrência de diarreia grau ≥2, com retomada quando o evento fosse manejado para grau ≤1, ou redução da dose nos casos persistentes (grau ≥2 ou grau ≥3).6
Nos dois ensaios (MONARCH 2 e 3) os protocolos permitiram a suspensão de abemaciclibe e / ou redução em até dois níveis de dose (isto é, de 150 mg para 100 mg ou 50 mg, todos b.i.d.), conforme necessidade e a natureza da toxicidade (hematológica ou não hematológica), gravidade, persistência e recorrência.6
Os resultados mostram que diarreia clinicamente significativa (definida como grau 2 ou 3) ocorreu no início do tratamento com abemaciclibe, com duração mediana de 9 a 12 dias para eventos grau 2 e de 6 a 8 dias nos eventos grau 3. A taxa mais alta (32% no MONARCH 2 e 20,8% no MONARCH 3) foi observada no primeiro ciclo de tratamento, com incidência decrescente em todos os ciclos subsequentes.6
Para o manejo, Rugo e colegas descrevem que grande parcela de pacientes (69% -76%) fez uso de medicamento antidiarreico, mais comumente loperamida. Menos de 3% (2.3% – 2.9%) dos pacientes descontinuaram o tratamento com abemaciclibe em consequência da diarreia6.
“Você precisa educar o paciente, inclusive a identificar o sintoma de diarreia aos primeiros sinais, adequar a dieta e junto com a prescrição de abemaciclibe orientar também sobre o uso de antidiarreicos, que bem utilizados são capazes de controlar até 76% dos casos”, explica Solange Sanches, oncologista do AC Camargo Cancer Center. “O manejo dos sintomas garante a adesão do paciente ao tratamento, para que ele possa derivar benefício de sobrevida livre de progressão e mesmo de sobrevida global”, destaca.
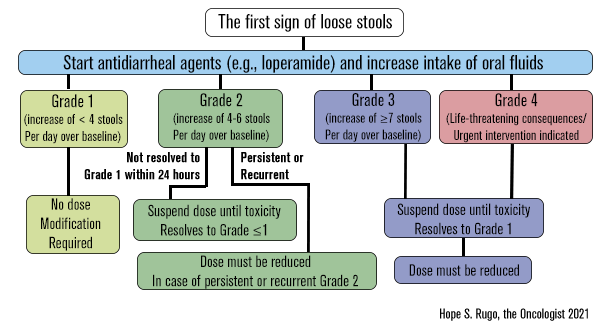
Fonte: Hope S. Rugo, the Oncologist 2021
Neutropenia
A neutropenia foi o evento adverso ≥3 mais frequentemente, relatado em 25% dos pacientes (MONARCH 2 e 3), e foi tratada principalmente com ajuste da dose. O uso de fator estimulador de colônia de granulócitos (GCSF) foi permitido por protocolo, consistente com as recomendações.6
O tempo médio para neutropenia clinicamente significativa (definida como grau ≥3) variou de 29 a 36,5 dias e o tempo médio para resolução variou de 11,5 a 15 dias (MONARCH 2 e 3).6
No MONARCH 2, as taxas mais altas de neutropenia clinicamente significativa ocorreram durante os dois primeiros ciclos (11,6% e 15,8%, respectivamente), com <10% em todos os ciclos subsequentes. No MONARCH 3, a tendência foi semelhante, com neutropenia clinicamente significativa em 6,4% e 11,0% nos ciclos 1 e 2 e ≤10% nos ciclos subsequentes. A descontinuação por neutropenia ocorreu em até 3% dos pacientes (1% –3%). A incidência de neutropenia febril ou outro evento grave (≥3) foi de 0,7%.6
Em síntese, a atual base de evidências mostra que abemaciclibe foi bem tolerado e o evento adverso mais comum foi gerenciado de forma eficaz por medicamentos de suporte e / ou ajustes de dose, sem prejuízo nos resultados clínicos.6
Indicações e cenários de tratamento
Abemaciclibe foi aprovado em setembro de 2017 pela Food and Drug Administration (FDA) em combinação com fulvestranto para mulheres com câncer de mama avançado ou metastático HR+, HER2− que progrediram após terapia endócrina7. A aprovação da agência norte-americana é baseada nos resultados de sobrevida livre de progressão (SLP) e taxa de resposta (ORR) observadas no ensaio MONARCH 2. Abemaciclibe também foi aprovado pela FDA (fevereiro de 2018) em combinação com um inibidor de aromatase não esteroidal, com base nos resultados do estudo MONARCH 3. Nos EUA, o novo inibidor de CDK 4/6 é o único atualmente aprovado como monoterapia para pacientes intensamente pré-tratados, diante da ORR observada no ensaio MONARCH 1.
No Brasil, a Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o registro do inibidor de ciclinas abemaciclibe para o tratamento de pacientes com câncer de mama avançado ou metastático, receptor hormonal positivo e HER2-negativo8. O registro sanitário foi aprovado para uso em três diferentes cenários: em combinação com um inibidor da aromatase como terapia endócrina inicial; em combinação com fulvestranto como terapia endócrina inicial ou após terapia endócrina; ou como agente único, após progressão da doença após terapia hormonal e quimioterapia. A aprovação é baseada nos estudos MONARCH 1, 2 e 3.
Assista também:
Vídeo exclusivo: os oncologistas Evandro Azambuja, do Institut Jules Bordet, na Bélgica; e Solange Sanches, do A.C.Camargo Cancer Center, em São Paulo, discutem o papel do inibidor de CDK4/6 abemaciclibe no tratamento do câncer de mama avançado receptor hormonal positivo, HER2-negativo. Em pauta, os resultados dos estudos MONARCH 2 e 3, com ênfase na qualidade de vida e no manejo de eventos adversos, como a diarreia. “Começar o tratamento com o inibidor de ciclina e uma terapia hormonal em primeira linha melhora não só o prognóstico, mas mantém a qualidade de vida dessas pacientes”, observa Azambuja.
Referências:
-
Sledge GW, Toi M, Neven P, et al. MONARCH 2: Abemaciclib in Combination With Fulvestrant in Women With HR+/HER2− Advanced Breast Cancer Who Had Progressed While Receiving Endocrine Therapy. Journal of Clinical Oncology 35, no. 25 (September 01, 2017) 2875-2884. doi: 10.1200/JCO.2017.73.7585
-
Sledge GW, Toi M, Neven P, et al. The Effect of Abemaciclib Plus Fulvestrant on Overall Survival in Hormone Receptor–Positive, ERBB2-Negative Breast Cancer That Progressed on Endocrine Therapy—MONARCH 2: A Randomized Clinical Trial. JAMA Oncol. 2020;6(1):116–124. doi:10.1001/jamaoncol.2019.4782
-
Goetz, M. P. et al. MONARCH 3: abemaciclib as initial therapy for advanced breast cancer. J. Clin. Oncol. 35, 3638–3646 (2017).
-
Johnston, S., Martin, M., Di Leo, A. et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. npj Breast Cancer 5, 5 (2019). https://doi.org/10.1038/s41523-018-0097-z
-
Kaufman PA, Toi M, Neven P, Sohn J, Grischke E-M, Andre V, et al. Health-related quality of life in MONARCH 2: abemaciclib plus fulvestrant in hormone receptor-positive, HER2-negative advanced breast cancer after endocrine therapy. Oncologist. 2020;25(2):e243–51
-
Rugo HS, Huober J, García-Sáenz JA et al (2020) Management of abemaciclib-associated adverse events in patients with hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer: safety analysis of MONARCH 2 and MONARCH 3. Oncologist. 10.1002/onco.13531
-
FDA approves abemaciclib for HR-positive, HER2-negative breast cancer – Disponível em https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-abemaciclib-hr-positive-her2-negative-breast-cancer / FDA approves abemaciclib as initial therapy for HR-positive, HER2-negative metastatic breast câncer – Disponível em https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-abemaciclib-initial-therapy-hr-positive-her2-negative-metastatic-breast-cancer
-
DIÁRIO OFICIAL DA UNIÃO - Publicado em 11/03/2019; Edição: 47; Seção: 1 – Suplemento; Página: 13 – Disponível em https://pesquisa.in.gov.br/imprensa/jsp/visualiza/index.jsp?data=11/03/2019&jornal=531&pagina=13








