 O oncologista Max Mano (foto), coordenador do Grupo de Câncer de Mama no Instituto do Câncer do Estado de São Paulo (ICESP) e médico do Hospital Sírio Libanês; e Rudinei Linck, médico residente em oncologia clínica pelo Hospital Sírio Libanês, abordam em artigo os subtipos moleculares em câncer de mama e sua importância para a tomada de decisões clínicas.
O oncologista Max Mano (foto), coordenador do Grupo de Câncer de Mama no Instituto do Câncer do Estado de São Paulo (ICESP) e médico do Hospital Sírio Libanês; e Rudinei Linck, médico residente em oncologia clínica pelo Hospital Sírio Libanês, abordam em artigo os subtipos moleculares em câncer de mama e sua importância para a tomada de decisões clínicas.
 O oncologista Max Mano (foto), coordenador do Grupo de Câncer de Mama no Instituto do Câncer do Estado de São Paulo (ICESP) e médico do Hospital Sírio Libanês; e Rudinei Linck, médico residente em oncologia clínica pelo Hospital Sírio Libanês, abordam em artigo os subtipos moleculares em câncer de mama e sua importância para a tomada de decisões clínicas.
O oncologista Max Mano (foto), coordenador do Grupo de Câncer de Mama no Instituto do Câncer do Estado de São Paulo (ICESP) e médico do Hospital Sírio Libanês; e Rudinei Linck, médico residente em oncologia clínica pelo Hospital Sírio Libanês, abordam em artigo os subtipos moleculares em câncer de mama e sua importância para a tomada de decisões clínicas.
{jathumbnail off}Por Max Mano e Rudinei Linck
Nas últimas décadas, vários grupos de pesquisadores realizaram trabalhos que contribuíram para o melhor entendimento da biologia do câncer de mama (CM). Alguns indicadores como grau de diferenciação histológica, imunoexpressão de receptores hormonais e amplificação do gene Her21 já são velhos conhecidos e indicam maior ou menor agressividade da doença, contribuindo assim para a avaliação do risco de recorrência. O primeiro “teste genômico” foi desenvolvido por pesquisadores alemães e chamado de UPA-PAI1. Este teste foi posteriormente validado clinicamente, entretanto, sua utilidade clínica mostrou ser apenas modesta, principalmente por questões inerentes à complexidade da tecnologia envolvida no exame2.
Após esta primeira experiência, a partir de importantes trabalhos realizados por diversos grupos de pesquisadores nas duas últimas décadas, o entendimento da biologia do CM tomou um novo rumo, culminando na publicação do clássico trabalho do então jovem pesquisador Charles Perou e colaboradores, brilhantemente intitulada “Portraits of Breast Cancer” (retratos do CM)3. Esta classificação – viabilizada pelo desenvolvimento de novas tecnologias que permitem a análise da expressão de um grande número de genes em um único teste – pôde separar o CM em 3 subtipos denominados “intrínsecos”: luminais, Her2-enriquecidos ou basalóides. Além da diversidade de expressão gênica, foi também demonstrado a variabilidade do comportamento clínico destes subtipos, com maior risco de recorrência observado nos subtipos Her2-enriquecidos e basalóides4. O valor científico desta classificação continua vivo nos dias atuais, tendo sido ela, inclusive, o embrião de testes comercialmente disponíveis e bastante utilizados no dia-a-dia da prática clínica moderna5.
Nos anos seguintes a esta publicação houve um rápido e profundo avanço na capacidade das tecnologias envolvidas no sequenciamento genético, com melhorias na eficiência e redução dos custos financeiros, ampliando a utilização destes testes. Com isso, estudos mais recentes sugerem que a classificação intrínseca conforme proposta por Charles Perou e colegas seja talvez simplista demais. Estudo recente de sequenciamento maciço de DNA, expressão gênica e proteômica em 2000 tumores, por exemplo, sugere a existência de 10 subtipos intrínsecos, em vez de apenas três ou quatro6. Outro estudo, mais focado em tumores triplo negativos, propõe que este subgrupo específico abrigue 6 “subtipos” que diferem entre si no comportamento clinico e resposta ao tratamento sistêmico7. Ainda, uma terceira publicação sugere que os carcinomas mamários triplo negativos são praticamente idênticos do ponto de vista genômico aos carcinomas serosos ovarianos de alto grau, com potenciais implicações no tratamento dessas doenças8. Neste meio tempo, o grupo de Charles Perou seguiu trabalhando no perfil intrínseco original, confirmando sua validade clínica4 e, como vimos acima, finalmente transformando estes dados em um teste comercial de grande utilidade clínica5.
Um ponto crítico deste artigo foi explicar a confusão que se formou ao longo dos anos entre perfil intrínseco “verdadeiro” e a estimação deste perfil através de marcadores imunohistoquímicos (IHQ), os quais são mais amplamente disponíveis e muito utilizados na prática clínica: receptor de estrógeno (RE), receptor de progesterona (RP), Her2 e Ki67. Um trabalho clássico de M. Cheang e co-autores estabeleceu correlações entre os marcadores de IHQ e a classificação intrínseca, tendo utilizado a taxa de expressão de Ki67 como divisor de águas entre os perfis Luminal A ou B. Neste estudo, foi sugerido 13.5% de índice de Ki67 como ponte de corte9. No entanto, neste mesmo trabalho fica evidente que a correlação do perfil intrínseco (PI) verdadeiro ocorre, na melhor das hipóteses, em pouco mais de 70% dos casos. Além disso, ao longo dos anos, críticas sobre a reprodutibilidade do índice de Ki67 entre diferentes avaliadores foram se acumulando10. Um dos mais belos estudos já publicados sobre o tema foi a análise secundária do estudo MINDACT, o grande estudo prospectivo controlado para validação do MammaPrint. Neste estudo, análises do BluePrint (um componente do MammaPrint utilizado para avaliar a classificação do PI) confirmam a suspeita de correlação imperfeita entre classificação baseada em IHQ ou por expressão gênica (Tabela 1) 11. Apesar de um rigoroso processo de revisão central da IHQ, 54% dos tumores classificados por IHQ como Luminal B foram reclassificados como Luminal A pelo BluePrint; além de reclassificar 38% e 5% dos Her2 superexpressos como Luminais e Basalóides, respectivamente. Embora a classificação baseada em IHQ seja bastante efetiva para tumores Triplo Negativos e Her2 positivos, o mesmo não pode ser dito para a diferenciação entre os Luminais A e B. Exceto em um contexto experimental rigorosamente controlado (o que não ocorre na maioria dos laboratórios de patologia), a utilização de parâmetros de IHQ para definição de PI não é viável. Por estas razões, os autores deste texto desaconselham as tentativas de classificar tumores entre Luminal A ou B por IHQ e, especialmente, desaconselham que esta tentativa de classificação seja utilizada para tomada de decisões clínicas.
Os tumores Triplo Negativos, definido através dos marcadores de IHQ – a única avaliação que utilizamos na prática clínica rotineira – possuem a tendência de serem mais agressivos, além de apresentar recorrências frequentes (especialmente em casos mais avançados) e precoces (a maioria dentro dos primeiros 5 anos)12. Ao mesmo tempo, são muito sensíveis à quimioterapia, o que aumenta a chance de sucesso no tratamento de tumores em estágios iniciais13. No entanto, a ausência de uma erradicação da doença pela quimioterapia neoadjuvante (ausência de resposta patológica completa) aumenta dramaticamente o risco de recorrência, ressaltando a importância da quimioterapia citotóxica para o sucesso do tratamento deste tipo de doença14. Em estágio metastático, os tumores Triplo Negativos são de prognóstico bastante reservado devido, pelo menos em parte, à ausência de uma terapia-alvo eficaz neste perfil de doença. Os tumores Her2 positivos tem um comportamento inato muito semelhante ao subtipo Triplo Negativo. Entretanto, na prática atual há uma diferença crucial: a existência de terapias-alvo altamente eficazes. Estas terapias aumentam dramaticamente a chance de cura da doença Her2 positiva não metastática e prolonga significativamente a sobrevida de pacientes com doença metastática.
Finalmente, os tumores Luminais A ou B (essa diferenciação, como previamente salientado, exige a realização de teste genômico como o Prosigna ou o BluePrint/MammaPrint) apresentam comportamentos distintos. Os tumores Luminal B possuem um maior risco de recorrência e apresentam uma maior taxa de proliferação tumoral, o que leva a uma tendência de maior necessidade de quimioterapia adjuvante. Já os tumores de perfil Luminal A são pouco proliferativos, de melhor prognóstico e geralmente menos responsivos à quimioterapia. Diversos estudos têm mostrado que os tumores Luminais A “verdadeiros” são os que mais vemos na prática clínica, representando mais de 50% dos casos. No estudo MINDACT, 63% dos tumores eram deste perfil (vs 47% se classificados apenas pela IHQ convencional) (Tabela 1)11. Além disso, os tumores Luminais podem apresentar um padrão de recorrência tardia e muitos podem merecer consideração para tratamento de hormonioterapia estendida (além de 5 anos)15,16.
Algumas ferramentas que vêm sendo utilizadas na prática clínica (a um custo por vezes proibitivo) são as assinaturas genéticas, ou genômicas (termo este preferido pelos autores – também utilizado para não haver confusão com o sequenciamento genético realizado em DNA de linhagem germinativa para avaliação de predisposição hereditária a câncer). Os testes genômicos avaliam a expressão de alguns genes nas células tumorais para determinar prognóstico e necessidade de quimioterapia adjuvante. Um destes testes, já citado neste texto e comercializado sob o nome de Prosigna, faz uso do conhecimento do PI para o auxílio na tomada de decisões clínicas5. O perfil Luminal A – o qual, curiosamente, por uma questão meramente regulatória, só pode ser laudado no exame quando feito na Alemanha, mas não quando feito nos Estados Unidos – indica um risco menor que 5% de recorrência metastática, inclusive após um tempo de seguimento tão longo quanto 15 anos17. O MammaPrint – utilizado para finalidades semelhantes ao Prosigna – fornece o escore principal para classificação entre “alto risco” ou “baixo risco” de recorrência metastática, e também uma análise secundária chamada BluePrint (também já citado no texto) para a identificação do PI do tumor. Normalmente, espera-se que o perfil “baixo risco” seja enriquecido de tumores de PI Luminal A. Outros testes – também robustamente validados – fornecem informações semelhantes sobre prognóstico precoce e tardio, além de predição do benefício com a quimioterapia adjuvante. Entretanto, estes testes não se valem da utilização dos mesmos genes para a classificação do PI, mas sim, de outros genes igualmente relevantes. Dentre estes exames deve-se citar o Oncotype DX, o BCI e o EndoPredict18-20.
Em conclusão, a classificação molecular do PI é um grande avanço no entendimento do comportamento biológico e clínico do CM. Esta abordagem está certamente contribuindo para melhorias na eficácia dos tratamentos, assim como na redução da indicação de quimioterapia adjuvante a pacientes que pouco se beneficiam desta abordagem. Vimos também, nesta breve revisão, que podemos aferir o perfil molecular do tumor por IHQ de maneira razoavelmente confiável para os tumores Triplo Negativos e Her2 positivos. Entretanto, mesmos para estes tumores a correlação com o PI original não é perfeita. Já a discriminação entre Luminal A ou Luminal B por IHQ é muito difícil, talvez impossível em condições normais, pois a avaliação do Ki67 na rotina clinica é bastante problemática. Sendo assim, para diferenciar entre Luminal A ou B – ou ainda, entre os tumores de “alto” ou “baixo” risco – deve-se recorrer, se esta informação for relevante para o paciente, a uma assinatura genômica.
Ainda restam questões importantes a serem esclarecidas, por exemplo, as discordâncias entre a classificação por IHQ e o PI que ocorrem entre 20-50% dos casos. Por exemplo, o que fazer com um tumor classificado como Her2 positivo por IHQ, mas que se enquadra em outro perfil pela classificação intrínseca? Tais situações estão longe de serem raras, conforme demonstrado no estudo CALGB40601. Neste estudo foi também demonstrado que tumores Her2 positivos por IHQ (e/ou FISH) porém não Her2 enriquecidos por PI respondem com menos intensidade ao duplo bloqueio anti-Her221. A propósito, conforme demonstrado em diferentes estudos, casos de PI Her2 superexpressos – e mesmo Basalóides – também podem ser identificados em tumores classificados como Luminal por IHQ11.
Provavelmente, todas estas questões discutidas neste texto irão continuar a evoluir e o tempo mostrará que a classificação molecular dos tumores é ainda mais complexa do que nos parece hoje. É possível que seja necessário, além do perfil de expressão gênica – utilizado nas assinaturas atuais – incluir também dados de sequenciamento de DNA (perfil mutacional, alterações no número de cópias, translocações cromossômicas), de alterações epigenética e do perfil proteômico, como já sugerido em importantes estudos6,8. Neste momento, para fins de tomada de decisões clínicas, a IHQ é suficiente na maioria das vezes – especialmente quando o tumor é classificado como Her2 positivo ou Triplo Negativo. Para os perfis Luminais, já pode ser necessário o uso de ferramentas adicionais que, infelizmente, ainda possuem alto custo e estão muito distantes de se tornarem amplamente disponíveis.
TABELA 1. Correlação entre perfil intrínseco versus imunoistoquímicos no estudo MINDACT
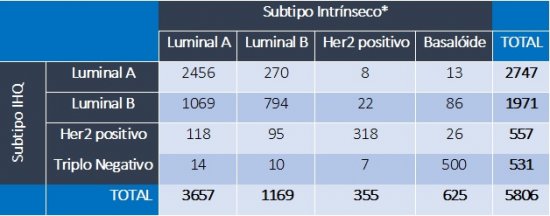
Subtipo IHQ: classificação por imunoistoquímica. *Subtipo definido por BluePrint/MammaPrint.
Adaptado de Cardoso F. et al, SABCS 2016.
*Autores: Max Mano é Pesquisador e Coordenador do Grupo de Câncer de Mama no Instituto do Câncer do Estado de São Paulo (ICESP); oncologista clínico do Hospital Sírio Libanês e Prof. Dr. Assistente da Disciplina de Oncologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP).
Rudinei Linck é médico residente em oncologia clínica pelo Hospital Sírio Libanês.
Referências
1 - DJ Slamon, GM Clark, SG Wong, et al. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 09 Jan 1987: Vol. 235, Issue 4785, pp. 177-182
2 - Harbeck N1, Schmitt M, Meisner C, et al. Ten-year analysis of the prospective multicentre Chemo-N0 trial validates American Society of Clinical Oncology (ASCO)-recommended biomarkers uPA and PAI-1 for therapy decision making in node-negative breast cancer patients. Eur J Cancer. 2013 May;49(8):1825-35. doi: 10.1016/j.ejca.2013.01.007
3 - Charles M. Perou, Therese Sørlie, Michael B. Eisen, et al. Molecular portraits of human breast tumours. Nature 406, 747-752 (17 August 2000). doi:10.1038/35021093
4 - Parker JS, Mullins M, Cheang MC, et al. Supervised risk predictor of breast cancer based on intrinsic subtypes. J Clin Oncol. 2009 Mar 10;27(8):1160-7. doi: 10.1200/JCO.2008.18.1370
5 - Gnant M, Filipits M, Greil R, et al. Predicting distant recurrence in receptor-positive breast cancer patients with limited clinicopathological risk: using the PAM50 Risk of Recurrence score in 1478 postmenopausal patients of the ABCSG-8 trial treated with adjuvant endocrine therapy alone. Ann Oncol. 2014 Feb;25(2):339-45. doi: 10.1093/annonc/mdt494.
6 - Curtis C, Shah SP, Chin SF, et al. The genomic and transcriptomic architecture of 2,000 breast tumours reveals novel subgroups. Nature. 2012 Apr 18;486(7403):346-52. doi: 10.1038/nature10983.
7 - Lehmann BD, Bauer JA, Chen X, et al. Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies. J Clin Invest. 2011 Jul;121(7):2750-67. doi: 10.1172/JCI45014.
8 - Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast tumours. Nature. 2012 Oct 4;490(7418):61-70. doi: 10.1038/nature11412.
9 - Cheang MC, Chia SK, Voduc D, et al. Ki67 index, HER2 status, and prognosis of patients with luminal B breast cancer. J Natl Cancer Inst. 2009 May 20;101(10):736-50. doi: 10.1093/jnci/djp082.
10 - Guiu S, Michiels S, André F, et al. Molecular subclasses of breast cancer: how do we define them? The IMPAKT 2012 Working Group Statement. Ann Oncol. 2012 Dec;23(12):2997-3006. doi: 10.1093/annonc/mds586.
11 - Cardoso F, Slaets L, de Snoo F, et al. Can surrogate pathological subtyping replace molecular subtyping? Outcome results from the MINDACT trial. San Antonio Breast Cancer Symposium 2016, abs PD7-01.
12 - Dent R, Trudeau M, Pritchard KI, et al. Triple-negative breast cancer: clinical features and patterns of recurrence. Clin Cancer Res. 2007 Aug 1;13(15 Pt 1):4429-34.
13 - Fisher B, Dignam J, Tan-Chiu E, et al. Prognosis and treatment of patients with breast tumors of one centimeter or less and negative axillary lymph nodes. J Natl Cancer Inst. 2001 Jan 17;93(2):112-20.
14 - Liedtke C, Mazouni C, Hess KR, et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J Clin Oncol. 2008 Mar 10;26(8):1275-81. doi: 10.1200/JCO.2007.14.4147.
15 - Goss PE, Ingle JN, Martino S, ET AL. Randomized trial of letrozole following tamoxifen as extended adjuvant therapy in receptor-positive breast cancer: updated findings from NCIC CTG MA.17. J Natl Cancer Inst. 2005 Sep 7;97(17):1262-71.
16 - Goss PE, Ingle JN, Pritchard KI, et al. Extending Aromatase-Inhibitor Adjuvant Therapy to 10 Years. N Engl J Med. 2016 Jul 21;375(3):209-19. doi: 10.1056/NEJMoa1604700.
17 - Filipits M, Nielsen TO, Rudas M, ET AL. The PAM50 risk-of-recurrence score predicts risk for late distant recurrence after endocrine therapy in postmenopausal women with endocrine-responsive early breast cancer. Clin Cancer Res. 2014 Mar 1;20(5):1298-305. doi: 10.1158/1078-0432.CCR-13-1845.
18 - Sparano JA, Gray RJ, Makower DF, et al. Prospective Validation of a 21-Gene Expression Assay in Breast Cancer. N Engl J Med. 2015 Nov 19;373(21):2005-14. doi: 10.1056/NEJMoa1510764. Epub 2015 Sep 27.
19 - Filipits M, Rudas M, Jakesz R, et al. A new molecular predictor of distant recurrence in ER-positive, HER2-negative breast cancer adds independent information to conventional clinical risk factors. Clin Cancer Res. 2011 Sep 15;17(18):6012-20. doi: 10.1158/1078-0432.CCR-11-0926.
20 - Sgroi DC, Carney E, Zarrella E, et al. Prediction of late disease recurrence and extended adjuvant letrozole benefit by the HOXB13/IL17BR biomarker. J Natl Cancer Inst. 2013 Jul 17;105(14):1036-42. doi: 10.1093/jnci/djt146.
21 - Carey LA, Berry DA, Cirrincione CT, et al. Molecular Heterogeneity and Response to Neoadjuvant Human Epidermal Growth Factor Receptor 2 Targeting in CALGB 40601, a Randomized Phase III Trial of Paclitaxel Plus Trastuzumab With or Without Lapatinib. J Clin Oncol. 2016 Feb 20;34(6):542-9. doi: 10.1200/JCO.2015.62.1268.