A cardiotoxicidade secundária ao tratamento do câncer é um problema crescente para cardiologistas e oncologistas, uma vez que sua ocorrência pode ter um grande impacto nos resultados do tratamento e na evolução clínica do paciente. A manifestação mais típica da toxicidade cardíaca é a disfunção sistólica do ventrículo esquerdo, levando à insuficiência cardíaca. Entretanto, o espectro de agressões ao sistema cardiovascular é mais amplo e inclui: síndrome coronariana aguda, hipertensão, arritmias, pericardite e fenômenos tromboembólicos. Pacientes que estão em tratamento oncológico se tornam mais propensos a apresentar problemas cardíacos e apresentam maior tendência a desenvolver doença cardíaca precoce e morte quando comparados à população geral. A melhor abordagem para a cardiotoxicidade é a prevenção.
É essencial que todo paciente para o qual se planeja um tratamento com potencial cardiotóxico tenha seu risco cardiovascular avaliado e que seja traçada uma estratégia de monitoramento da função cardíaca. Acompanhamento periódico da função ventricular com ecocardiograma, dosagem de biomarcadores, e limitação de dose de quimioterápicos, como antraciclina, são medidas que podem ser adotadas no acompanhamento cardio-oncológico.
Os efeitos cardiotóxicos da quimioterapia podem potencialmente ser reduzidos pelo uso concomitante dos inibidores da enzima conversora de angiotensina, bloqueadores do receptor de angiotensina ou beta bloqueadores. Terapia antiplaquetária ou anticoagulante pode ser indicada em pacientes com um estado de hipercoagulabilidade relacionado ao câncer, ou ao seu tratamento. Cardio-Oncologia ou Onco-cardiologia são termos criados para descrever uma medicina integrativa entre cardiologistas e oncologistas. Um diálogo aberto entre estas duas especialidades se faz fundamental para uma assistência de excelência ao paciente com câncer.
A cardiotoxicidade secundária ao tratamento do câncer é um problema crescente para cardiologistas e oncologistas, uma vez que sua ocorrência pode ter um grande impacto nos resultados do tratamento e na evolução clínica do paciente. A manifestação mais típica da toxicidade cardíaca é a disfunção sistólica do ventrículo esquerdo, levando à insuficiência cardíaca. Entretanto, o espectro de agressões ao sistema cardiovascular é mais amplo e inclui: síndrome coronariana aguda, hipertensão, arritmias, pericardite e fenômenos tromboembólicos. Pacientes que estão em tratamento oncológico se tornam mais propensos a apresentar problemas cardíacos e apresentam maior tendência a desenvolver doença cardíaca precoce e morte quando comparados à população geral. A melhor abordagem para a cardiotoxicidade é a prevenção.
É essencial que todo paciente para o qual se planeja um tratamento com potencial cardiotóxico tenha seu risco cardiovascular avaliado e que seja traçada uma estratégia de monitoramento da função cardíaca. Acompanhamento periódico da função ventricular com ecocardiograma, dosagem de biomarcadores, e limitação de dose de quimioterápicos, como antraciclina, são medidas que podem ser adotadas no acompanhamento cardio-oncológico.
Os efeitos cardiotóxicos da quimioterapia podem potencialmente ser reduzidos pelo uso concomitante dos inibidores da enzima conversora de angiotensina, bloqueadores do receptor de angiotensina ou beta bloqueadores. Terapia antiplaquetária ou anticoagulante pode ser indicada em pacientes com um estado de hipercoagulabilidade relacionado ao câncer, ou ao seu tratamento. Cardio-Oncologia ou Onco-cardiologia são termos criados para descrever uma medicina integrativa entre cardiologistas e oncologistas. Um diálogo aberto entre estas duas especialidades se faz fundamental para uma assistência de excelência ao paciente com câncer.
{jathumbnail off}Nos últimos 20 anos, avanços no diagnóstico precoce e no tratamento do paciente oncológico propiciou significativa redução na mortalidade. A evolução do tratamento cirúrgico, do aprimoramento e do surgimento de novas classes de quimioterapia (QT) e das técnicas de radioterapia (RT) resultaram em aumento da sobrevida desses pacientes1. Ao mesmo tempo, a incidência e a mortalidade das doenças cardiovasculares continuam a crescer em todo mundo. As doenças cardiovasculares aumentam o risco de complicações do tratamento do câncer e, o tratamento oncológico, por si só, pode causar doença cardiovascular. Assim, cada vez mais, iremos observar complicações cardiovasculares nos pacientes com câncer, tanto por toxicidade direta da QT ou RT, quando por fatores de risco do próprio paciente, como idade, obesidade, tabagismo, dislipidemia, hipertensão arterial sistêmica (HAS), diabetes Melitus (DM) e fatores genéticos. É fato que a sobrevida de alguns tipos de câncer, hoje, pode ser melhor que a sobrevida de pacientes com insuficiência cardíaca avançada. Sobreviver ao câncer, ao custo de desenvolver cardiotoxicidade, não é uma estratégia atrativa.
A manifestação mais temida e frequente de cardiotoxicidade é a disfunção ventricular esquerda, levando à insuficiência cardíaca congestiva (ICC). Porém, o espectro de doenças, que podem acometer o sistema cardiovascular, inclui: síndrome coronariana aguda (SCA), Hipertensão arterial sistêmica (HAS), arritmias, doenças do pericárdio e eventos tromboembólicos 2. Estima-se que existam, nos Estados Unidos e Europa, aproximadamente 11 milhões de sobreviventes de câncer3. Muitos deles submetidos a tratamento quimioterápico e radioterápico, com potencial para desenvolvimento de cardiotoxicidade tardia.
Assim sendo, se faz necessário que os pacientes em tratamento de câncer ou aqueles que foram expostos a QT ou RT sejam vistos como de alto risco para desenvolvimento de doenças cardiovasculares e tenham seu risco avaliado e monitorado, com intuito de evitar eventos adversos agudos e suas complicações a longo prazo. Para satisfazer esta demanda, criou-se a Cardio-Oncologia. O neologismo foi introduzido na literatura médica em 1996, para descrever um novo campo de medicina integrativa entre cardiologistas e oncologistas. Atualmente, a Cardio-Oncologia visa o desenvolvimento de uma interação bem próxima entre as duas especialidades, investigando novas estratégias, coletando novas evidências e criando um conhecimento interdisciplinar para o melhor tratamento deste grupo de pacientes.
Há evidências crescentes de que pacientes previamente tratados com QT ou RT têm seu risco cardiovascular aumentado. O risco de morte de origem cardíaca nestes pacientes é maior que o risco de recorrência do tumor, com uma taxa de mortalidade 7 vezes maior, risco de insuficiência cardíaca 15 vezes maior e risco de morte 10 vezes maior por doença cardiovascular, quando comparados com a população em geral4.
No seguimento a longo prazo de pacientes que sobreviveram ao câncer, observa-se uma maior incidência de HAS, dislipidemia, SCA e acidente vascular cerebral (AVC). O impacto no risco cardiovascular é tão importante que a exposição prévia à QT tem sido comparada ao risco atribuído ao tabagismo5.
Por essa razão, pacientes expostos previamente a QT devem merecer um acompanhamento cardiológico regular, assim como os pacientes portadores dos demais fatores de risco tradicionais. A hipótese atual mais convincente é que, durante a longa trajetória do tratamento oncológico, os pacientes são expostos a repetidas agressões ao sistema cardiovascular, associado a diversas mudanças em seu estilo de vida6. Após o diagnóstico de câncer, é comum que os pacientes parem de fazer atividade física, tenham tendência a aumentar o peso e fiquem depressivos (sabidamente um novo fator de risco cardiovascular). Estes fatores, juntos, fazem os pacientes mais vulneráveis as agressões ao sistema cardiovascular e aumentam seu risco de doença cardiovascular precoce.(FIGURA 1).
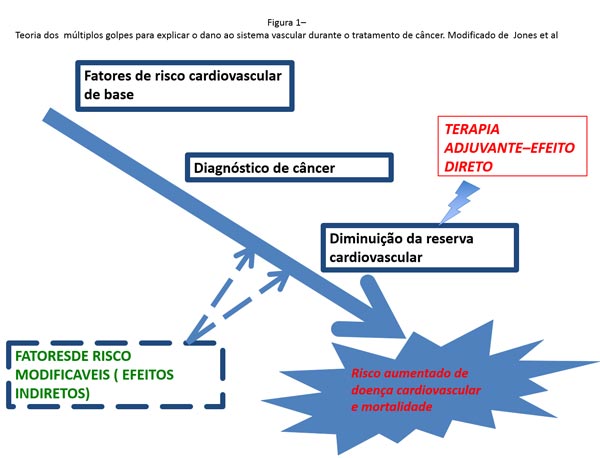
A identificação do paciente com câncer de alto risco para desenvolvimento de complicações cardiovasculares, durante o tratamento oncológico, é o ponto chave para reduzir a morbidade e mortalidade relacionada a cardiotoxicidade. Este monitoramento começa com a coleta de história clínica, que aborde os antecedentes cardiovasculares, e a presença dos fatores de risco clássico para as doenças cardiovasculares. Além disso, o tipo e as dosagens da quimioterapia planejada, também interferem na classificação do risco cardiovascular.
As principais drogas relacionadas ao desenvolvimento de cardiotoxicidade, tendo em vista sua utilização e incidência de ICC, são as antraciclinas, seguidas de ciclofosfamida e trastuzumabe. Nos eventos isquêmicos agudos, encontramos a cisplatina e o 5 fluoracil (5 FU). Neste contexto podemos imaginar que qualquer fator que estresse o sistema cardiovascular, antes do início dos agentes quimioterápicos, poderia aumentar a chance de efeitos tóxicos.
Por exemplo, em um paciente com doença coronariana prévia, o risco de desenvolvimento de isquemia miocárdica, quando exposto a cisplatina ou 5 FU é maior do que em um paciente com coronárias saudáveis.
A associação de tratamentos, especialmente a radioterapia combinada com quimioterapia, aumenta o risco de desenvolvimento de toxidade cardíaca como miocardiopatia e isquemia miocárdica.
A correta estratificação do risco cardiovascular, antes do início do tratamento, se faz fundamental para a prevenção da toxicidade, uma vez que, diante da necessidade de um tratamento oncológico ou hematológico agressivo, alguns efeitos colaterais cardiovasculares não poderão ser evitados, mas podem ser minimizados, se uma estratégia preventiva for adotada desde o início. Diferentes regimes de tratamento podem ser dados para um mesmo paciente e o risco de cardiotoxicidade deve pesar na decisão do oncologista. Além disso, a adoção de medidas que possam reduzir a incidência de toxidade, como utilização de doses menores de antraciclina, infusão de drogas de modo contínuo e uso de antraciclinaslipossomais, são sabidamente estratégias protetoras para o sistema cardiovascular.
Uma outra abordagem interessante para a identificação de pacientes de maior risco de cardiotoxicidade é a avaliação do perfil genético. Até o momento, há alguns estudos pequenos, porém com resultados fascinantes. As modificações genéticas que influenciam o risco individual de toxicidade à antraciclina, por exemplo, envolvem alterações no metabolismo e no transporte celular e na formação de radicais livres, estando envolvida a NADPH oxidase. A realização de testes para identificar polimorfismos destes nucleotídeos pode ser de grande ajuda na predição do risco para o surgimento de cardiotoxicidade, especialmente para a identificação de pacientes de baixo risco (valor preditivo negativo de 96%) 7.
Uma definição padronizada de cardiotoxicidade é essencial para fins assistenciais e de pesquisa nessa população. Nas últimas duas décadas, as definições de cardiotoxicidade dos ensaios clínicos de oncologia são baseadas nas medidas da fração de ejeção do ventrículo esquerdo (FEVE). O Instituto Nacional de Saúde (NIH) define cardiotoxicidade segundo a FEVE8:
Grau I: redução assintomática da FEVE entre 10% e 20%
Grau II: redução da FEVE abaixo de 20% ou abaixo do normal
Grau III: insuficiência cardíaca sintomática
A cardiotoxicidade apresenta-se de forma aguda, subaguda ou crônica. A cardiotoxicidade aguda ou subaguda caracteriza-se por alterações súbitas na repolarização ventricular, alterações no intervalo Q-T, arritmias supraventriculares e ventriculares, síndromes coronarianas agudas, pericardite e miocardite, geralmente observadas desde o início até 14 dias após o término do tratamento.
A cardiotoxicidade crônica pode ser diferenciada em dois tipos, de acordo com o início dos sintomas clínicos. O primeiro subtipo ocorre dentro de um ano após o término da quimioterapia, e o segundo ocorre geralmente após um ano do término da quimioterapia. A manifestação mais típica de cardiotoxicidade crônica é a disfunção ventricular sistólica ou diastólica que pode levar a insuficiência cardíaca congestiva até a morte cardiovascular.
O surgimento de disfunção ventricular esquerda (DVE) durante o tratamento de câncer não só afeta negativamente a evolução cardiológica como pode também limitar as possibilidades de tratamento oncológico. Assim, a presença de DVE restringe as opções de terapias, sendo usualmente preferível neste contexto a utilização de drogas menos agressivas e, conseqüentemente, menos eficazes. O desenvolvimento de DVE e conseqüente ICC se relaciona a vários tipos de drogas quimioterápicas (Tabela 1).
Tabela 1: Agentes quimioterápicos utilizados no tratamento do câncer e a incidência de cardiotoxicidade (redução da fração de ejeção e/ou insuficiência cardíaca)
| Agente quimioterápico | Incidência (%) de disfunção ventricular ou insuficiência cardíaca | Frequência de uso |
|---|---|---|
| Antraciclinas (doxorrubicina, epirrubicina, idarrubicina) | 5% a 35% dos casos (dose acima de 400 mg/m2) | ++++ |
| Agentes alquilantes (ciclofosfamida, ifosfamida) | 5% a 25% dos casos | ++++ |
| Agentes antimicrotúbulos (docetaxel, paclitaxel) | 2% a 10% dos casos | +++ |
| Agente quimioterápico | Incidência (%) de disfunção ventricular ou insuficiência cardíaca | Frequência de uso |
|---|---|---|
| Trastuzumabe | 2% a 28% dos casos | ++ |
| Bevacizumabe | 2% a 10% dos casos | ++ |
| Sunitinibe | 3% a 10% dos casos | ++ |
I Diretriz Brasileira de Cardio-Oncologia. Arq Bras Cardiol 2011; 96: 1-52
As antraciclinas causam dano irreversível ao cardiomiócito, sendo esta agressão dose dependente e acumulativa (disfunção tipo 1). Já a agressão causada pelo trastuzumab é reversível e não dose dependente (disfunção tipo II)9. Além disso, o espectro de manifestações da cardiotoxicidade é amplo e vai desde quadros subclínicos, em que a disfunção ventricular ocorre de maneira silenciosa, até quadros de ICC descompensada com disfunção sistólica grave. Dados recentes mostram que o diagnóstico precoce, principalmente em sua fase subclínica é determinante para o sucesso do tratamento, uma vez que quanto mais tardio o início da terapia clássica para ICC com os inibidores da enzima conversora de angiotensina (IECA) ou beta bloqueadores (BB) desde o surgimento da lesão cardíaca, menor a chance de recuperação da função ventricular9. Estes dados reforçam a necessidade de um diagnóstico precoce e em tempo real. Neste cenário clínico, a utilização dos biomarcadores e exames de imagem que detectem a lesão cardíaca antes da queda da fração de ejeção ao ecocardiograma é uma estratégia atrativa. Estudos da Itália 11 mostraram que após uma quimioterapia agressiva podemos identificar uma elevação de troponina sérica até 72 horas, indicando lesão ao cardiomiócito.
Esta elevação precoce foi preditora de redução futura (1 ano) da função ventricular, principalmente se essa elevação persistia por 1 mês após o fim da quimioterapia. Nos métodos de imagem, as avaliações vão além da medida da função ventricular. Anormalidades nas medidas de Doppler tecidual e nos valores de strain (índice de deformidade do miocárdio) ao ecocardiograma podem ser identificadas, precocemente, após a quimioterapia e sua persistência, após 3 meses do término do tratamento, pode ser preditor de queda da fração de ejeção em 1 ano12. Estudos como estes levaram à publicação de diretrizes da Sociedade Americana de ecocardiografia com orientações para seguimento deste grupo de pacientes com ênfase na utilização das medidas de strain tecidual.
Em pacientes em uso de antraciclinas, o monitoramento varia conforme a dose acumulada e de acordo com a evolução clínica e inclui a dosagem de biomarcadores (quadro 1).
| Dose acumulada de antraciclina (mg/m2)** | Antes do tratamento | Durante o tratamento | Ao final do tratamento | Primeiro ano após o tratamento | 2o ao 5o ano após o tratamento | >5o ano após o tratamento |
|---|---|---|---|---|---|---|
| <200 | Sim | Quando clinicamente indicado | Sim | Controle com 1 ano | Controle com 2 anos e 5 anos | Quando clinicamente indicado |
| 200-300 | Sim | Após 200 mg/m2 | Sim | Controle com 6 meses e 1 ano | Controle com 2 anos, 3 anos e 5 anos | Quando clinicamente indicado |
| 300-400 | Sim | Após 200, 300, 350 mg/m2 | Sim | Controle com 6 meses e 1 ano | Controle anual | Controle a cada 2 anos |
| >400 | Sim | Após 200, 300, 350 e 400 mg/m2 | Sim | Controle com 3 meses, 6 meses e 1 ano | Controle anual | controle anual |
Monitoramento cardíaco inclui: consulta cardiológica, avaliação da função ventricular, dosagens de troponina (esta última apenas durante o tratamento quimioterápico)
** As doses cumulativas são referentes à doxorrubicina; para o mitoxantrone, multiplica-se a dose por 0,2 para a epirrubicina, e as preparações lipossomais multiplica-se a dose por 1,5.
I Diretriz Brasileira de Cardio-Oncologia. Arq Bras Cardiol 2011; 96:1-52
Ainda no cenário da insuficiência cardíaca, merece destaque a cardiotoxicidade relacionada ao trastuzumabe. O uso do anticorpo monoclonal trastuzumabe, dirigido contra o receptor HER2, revolucionou o tratamento do câncer de mama positivo para HER2. Entretanto, foi observado um aumento da incidência de disfunção miocárdica nesses pacientes, principalmente com o uso concomitante das antraciclinas.
O mecanismo da cardiotoxicidade associada ao trastuzumabe está relacionado à expressão do receptor HER2 na superfície dos miócitos e à interação entre o trastuzumabe e a sinalização do HER2 no coração. O quadro clínico da toxicidade miocárdica do trastuzumabe é espectral, variando desde a ausência de sintomas até a ocorrência de insuficiência cardíaca congestiva. Felizmente, na maioria dos casos, a disfunção ventricular nos pacientes expostos ao trastuzumabe é reversível após a interrupção do tratamento ou após o início da terapia farmacológica da insuficiência cardíaca. Em casos relatados de persistência da disfunção ventricular com dano permanente, os pacientes, usualmente, haviam sido previamente expostos a antraciclinas (quadro 2).
| Classe I | Manutenção do tratamento em pacientes assintomáticos com FEVE normal que não apresentam redução da FEVE | C |
| Classe I | Manutenção do tratamento em pacientes assintomáticos com queda da FEVE >10% ainda com valor dentro da normalidade. Repetir o ecocardiograma em 4 semanas | C |
| Classe I | Manutenção do tratamento em pacientes assintomáticos com queda da FEVE entre 10% e 15%, mas ainda com valor acima de 40%. Recomenda-se iniciar terapia com IECA e beta bloqueador e repetir ecocardiograma em 2 a 4 semanas. Se não houver recuperação, suspender o trastuzumabe | C |
| Classe I | Interrupção do tratamento em pacientes assintomáticos com queda de FEVE >15% ou FEVE >30%. Recomenda-se terapia com beta bloqueador e IECA. Repetir ecocardiograma em 2 a 4 semanas. Se a FEVE não melhorar, manter a terapia suspensa. Se FEVE estiver acima de 45%, pode-se reiniciar o trastuzumabe | C |
| Classe I | Pacientes sintomáticos com queda de FEVE >10% mas ainda com valor dentro da normalidade podem ter seu tratamento continuado. Recomenda-se terapia com IECA beta bloqueador. Repetir ecocardiograma em 2 a 4 semanas. Se a FEVE permanecer estável ou melhorar, a terapia deve ser mantida. Se houver queda, o trastuzumabe deve ser suspenso. | C |
| Classe I | Interrupção do tratamento em pacientes sintomáticos com queda de FEVE >15% | C |
I Diretriz Brasileira de Cardio-Oncologia. Arq Bras Cardiol 2011; 96:1-52
É ponto fundamental na abordagem da cardiotoxicidade que seja traçada uma estratégia preventiva e multidisciplinar. Os pacientes devem ser alertados e inseridos neste processo, colaborando com a adoção de uma dieta adequada e mantendo, sempre que possível, atividade física aeróbica regular. O desenvolvimento de diabetes e dislipidemia pode potencializar o risco de aterosclerose nestes pacientes, especialmente após radioterapia. Um outro importante benefício da atividade física é facilitar a identificação da limitação aos esforços precocemente, com detecção de cardiomiopatia incipiente. Esta identificação precoce é fundamental para que possamos tratar estes pacientes adequadamente e tornar o prognóstico cardíaco mais favorável.
Identificar o mais precoce possível o paciente oncológico sob risco de desenvolver cardiotoxicidade, com incorporação das estratégias preventivas no curso do tratamento, são os progressos que almejamos alcançar para garantir a adequada segurança cardiovascular no tratamento do câncer.
Autor(es):
 Ariane Vieira Scarlatelli Macedo - Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo. - vice-presidente do Grupo de Estudos de Cardio-Oncologia da Sociedade Brasileira de Cardiologia. Atua como consultora em cardio-oncologia para a rede OncoClínicas do Brasil.
Ariane Vieira Scarlatelli Macedo - Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo. - vice-presidente do Grupo de Estudos de Cardio-Oncologia da Sociedade Brasileira de Cardiologia. Atua como consultora em cardio-oncologia para a rede OncoClínicas do Brasil.
Gilberto de Lima Lopes Junior - Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo. - médico oncologista do Centro Paulista de Oncologia, coordenador do HCor Onco e diretor científico do Grupo Oncoclínicas do Brasil. É professor assistente de oncologia na Faculdade de Medicina da Universidade Johns Hopkins e editor associado da Universidade da ASCO.
Lucíola Pontes - Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo. - oncologista clínica do HCor-Onco
{jd_file file==17}
Referências
1. Suter TM, Ewer MS. Cancer drugs and the heart: impor- tance and management. Eur Heart J. Epub 2012 July 12. 10.1093/eurheart/ehs181. Available from: www.eurheart. oxofordjournal.org.
2. Yeh ET, Bickford CL. Cardiovascular complications of cancer therapy: incidence, pathogenesis, diagnosis, and management. J Am Coll Cardiol. 2009;53:2231–47.
3. American Cancer Society Cancer Facts & Figures. Can- cer, 2010. Available from: www.cancerfactsfigures/ cancerfactsfigures/cancerfacts-and-figures-2010.
4. Menna P, Salvatorelli E, Minotti G. Cardiotoxicity of antitumor drugs. Chem Res Toxicol 2008;21:978–89
5. Doyle JJ, Neugut AI, Jacobson JS, Grann VR, Hershman DL. Chemotherapy and cardiotoxicity in older breast cancer patients: a population-based study. Clin Oncol.2005;23:8597– 605.
6. Jones LW, Haykowsky MJ, Swartz JJ, Douglas PS, Mackey JR. Early breast cancer therapy and cardiovascular injury. J Am Coll Cardiol. 2007;50:1435– 41.
7. Visscher H, Ross CJD, Rassekh SR, et al. Pharmacogenomic Prediction of Anthracycline-Induced Cardiotoxicity in Children. J Clin Oncol. 2012;30(13):1422-1428.
8. Albini A, Pennesi G, Donatelli F, et al. Cardiotoxicity of Anticancer Drugs: The Need for Cardio-Oncology and Cardio-Oncological Prevention. J Natl Cancer Inst. 2012;102(1): 14–25.
9. I Diretriz de Cardio-Oncologia da Sociedade Brasileira de Cardiologia. Kalil Filho R, Hajjar LA, Bacal F, Hoff PM, Diz Mdel P, Galas FR et al. Arq Bras Cardiol. 2011;96(2 Suppl 1):1-52.
10. Cardinale D, Colombo A, Lamantia G, et al. Anthracy- cline-induced cardiomyopathy. Clinical relevance and re- sponse to pharmacologic therapy. J Am Coll Cardiol. 2010;55:213–20
11. Cardinale D, Sandri MT, Martinoni A, et al. Left ventricular dysfunction predicted by early troponin I release after high-dose chemotherapy. J Am Coll Cardiol. 2000;36(2):517-522.
12. Stoodley PW, Richards DA, Hui R. Two-dimensional myocardial strain imaging detects changes in left ventricular systolic function immediately after anthracycline chemotherapy. Eur J Echocardiogr. 2011;12(12):945-952.








