 Ensaio clínico de fase II que tem como investigador principal o oncologista Fernando Maluf (foto)* está aberto para recrutamento de pacientes com câncer de próstata metastático hormônio sensível. O estudo tem o objetivo de avaliar a eficácia e segurança de apalutamida nesse cenário e é promovido pelo LACOG-GU, com participação de dez centros brasileiros, públicos e privados.
Ensaio clínico de fase II que tem como investigador principal o oncologista Fernando Maluf (foto)* está aberto para recrutamento de pacientes com câncer de próstata metastático hormônio sensível. O estudo tem o objetivo de avaliar a eficácia e segurança de apalutamida nesse cenário e é promovido pelo LACOG-GU, com participação de dez centros brasileiros, públicos e privados.
 As diretrizes atuais consideram que a privação androgênica isoladamente ou associada a um antiandrogênico é o tratamento de escolha para pacientes com doença metastática hormônio sensível. Dados recentes mostram que a quimioterapia também traz benefícios para esses pacientes, que ainda representam um grupo com necessidades médicas não atendidas.
As diretrizes atuais consideram que a privação androgênica isoladamente ou associada a um antiandrogênico é o tratamento de escolha para pacientes com doença metastática hormônio sensível. Dados recentes mostram que a quimioterapia também traz benefícios para esses pacientes, que ainda representam um grupo com necessidades médicas não atendidas.
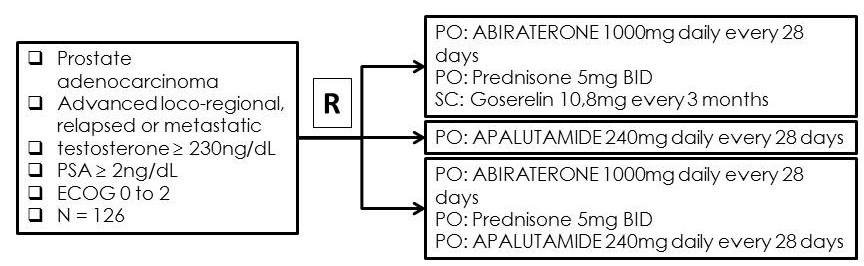
Neste estudo, pesquisadores do LACOG-GU avaliam apalutamida isoladamente ou associada a abiraterona, agente terapêutico que já se mostrou eficaz nesse perfil de pacientes. "A expectativa é inscrever 126 pacientes e o parâmetro principal é PSA ≤ 0,2 ng/ml na semana 25. Outros parâmetros incluem qualidade de vida, toxicidade e sobrevida global", explica Fernando Maluf.
Para Andrey Soares, chair do LACOG-GU, o estudo pode representar um novo paradigma. "Historicamente o câncer de próstata metastático sempre foi tratado com bloqueio androgênico. Desde a publicação dos estudos de Huggins em 1941 esta estratégia tem sido a base do tratamento desses pacientes", lembra o oncologista. No entanto, ele reforça que o bloqueio androgênico, apesar de importante no controle da doença, causa efeitos colaterais que impactam negativamente a qualidade de vida do paciente. "Até hoje não existe nenhum estudo randomizado para avaliar outras estratégias sem bloqueio androgênico nesta população. Este estudo tem um desenho muito importante e é original, o único no mundo a avaliar o tratamento desses pacientes sem bloqueio androgênico", diz Andrey, que faz questão de destacar o entusiasmo da comunidade científica internacional. "Se os pacientes que não receberam bloqueio androgênico tiverem resultados de eficácia semelhantes ou até mesmo melhores, com qualidade de vida superior, esses dados serão um novo marco no tratamento da doença prostática no cenário metastático", diz.
Contatos: Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo., fone (51) 3384 5334. Acompanhe abaixo os critérios de inclusão e exclusão.
Critérios de inclusão
1) São considerados elegíveis pacientes a partir de 18 anos, com adenocarcinoma de próstata confirmado histologicamente;
2) Pacientes virgens de hormônio com indicação para ADT nas seguintes configurações:
-
Doença locorregional avançada não passível de terapia local curativa (cirurgia ou radioterapia): categoria T T3 / 4 ou nodo positivo
-
Recorrência bioquímica após tratamento primário (cirurgia ou radioterapia): pacientes nos quais a terapia primária não é apropriada ou viável com tratamento prévio com cirurgia radical e / ou radioterapia, recidivando agora com pelo menos um dos critérios: PSA> = 4 ng/ml e subindo com tempo de duplicação inferior a 10 meses. ou PSA> = 20 ng / ml ou N + ou M +
-
Doença metastática recém-diagnosticada: Tany Nany M+
3) Paciente assintomático ou moderadamente sintomático em relação aos sintomas ósseos, ou seja, não há necessidade de radiação paliativa ou terapia com radioisótopo;
4) Nível de testosterona sem castração > 230ng / dL (> 8 nmol / L);
5) Nível basal de antígeno prostático específico (PSA) > 2ng / dL;
6) Status de desempenho ECOG de 0 a 2;
7) Função hematológica, hepática e renal adequada:
-
hemoglobina> 10 g / dL, neutrilos> 1,5 x 109 / L, plaquetas> 100 x 109 / L;
-
bilirrubina total <1,5x limite superior do normal (ULN); alanina (ALT) e aspartato (AST) aminotransferase <2,5 x LSN;
-
creatinina sérica <1,5x ULN; potássio> 3,5 mM;
8) Nenhum câncer anterior (exceto câncer de pele de células basais tratado);
9) Consentimento informado por escrito obtido antes de qualquer procedimento do estudo;
Critério de exclusão
1) Não são considerados elegíveis para este estudo clínico pacientes com Adenocarcinoma de próstata com diferenciação neuroendócrina ou histologia de pequenas células;
2) Recorrência bioquímica sem evidência de doença clínica ou radiológica;
3) Pacientes em uso de hormonioterapia ou quimioterapia antes da randomização. A exceção é para pacientes que receberam hormonioterapia para a doença localizada, que deve ter sido concluída há pelo menos 12 meses, administrada como terapia adjuvante ou neoadjuvante.
4) Pacientes que receberam radioterapia prévia para tumor primário ou para o tratamento de metástases 3 meses antes da inscrição;
5) Metástases cerebrais conhecidas ou suspeitas ou doença metastática leptomeníngea;
6) Quaisquer condições médicas concomitantes graves e / ou descontroladas que possam comprometer a participação no estudo;
7) Administração de procedimento cirúrgico terapêutico ou invasivo investigacional (não incluindo castração cirúrgica) dentro de 28 dias do Ciclo 1 Dia 1 ou atualmente inscrito em um estudo clínico;
8) Hepatite viral ativa ou sintomática ou doença hepática crônica; ascites ou distúrbios hemorrágicos secundários à disfunção hepática;
9)Tratamento atual ou anterior com medicações antiepilépticas para o tratamento de convulsões;
10) Função cardíaca prejudicada, incluindo qualquer um dos seguintes:
-
Hipertensão não controlada (pressão arterial sistólica ≥160 mmHg ou PA diastólica ≥95 mmHg);
-
Doença cardíaca clinicamente significativa, como evidenciado por infarto do miocárdio, ou eventos trombóticos arteriais ou história de insuficiência cardíaca nos últimos 6 meses, angina grave ou instável ou doença cardíaca de Classe II-IV (New York Heart Association -NYHA);
-
Fibrilação atrial existente com ou sem farmacoterapia. Outras arritmias cardíacas que requerem farmacoterapia;
-
História de convulsão ou condição que pode predispor à convulsão (incluindo, sem limitação, acidente vascular cerebral prévio, ataque isquêmico transitório ou perda de consciência ≤1 ano antes da randomização, malformação arteriovenosa cerebral ou massas intracranianas, como schwannomas e meningiomas, que estão causando edema ou efeito de massa);
11) Condições subjacentes específicas para agentes orais. Por exemplo: comprometimento da função gastrointestinal ou doença gastrointestinal que pode alterar significativamente a absorção de abiraterona ou apalutamida (por exemplo, doenças ulcerativas, náuseas descontroladas, vômitos, diarréia, síndrome de má absorção ou ressecção do intestino delgado);
12) Uso de medicamentos prescritos no prazo de 14 dias antes da dosagem ou medicação sem prescrição médica (OTC) nos 7 dias anteriores à dosagem;
13) Consumo de produto de toranja ou Erva de São João (hipericão) no prazo de 7 dias antes da administração;
O estudo tem colaboração da Janssen Pharmaceuticals.
*Fernando Maluf é oncologista clínico, diretor associado do Centro de Oncologia da BP – A Beneficência Portuguesa de São Paulo, e membro gestor do Centro de Oncologia do Hospital Israelita Albert Einstein.
Referência: Phase II Randomized Study of Abiraterone Acetate Plus ADT Versus APALUTAMIDE Versus Abiraterone and APALUTAMIDE in Patients with Advanced Prostate Cancer With Non-castrate Testosterone Levels - ClinicalTrials.gov identifier (NCT number): NCT02867020








