 Em artigo exclusivo, o oncologista Thiago William Carnier Jorge (foto), do Centro Paulista de Oncologia e do Centro de Oncologia do Hospital Oswaldo Cruz, em São Paulo, aborda as limitaçõe e avanços terapêuticos no cenário do hepatocarcinoma metastático.
Em artigo exclusivo, o oncologista Thiago William Carnier Jorge (foto), do Centro Paulista de Oncologia e do Centro de Oncologia do Hospital Oswaldo Cruz, em São Paulo, aborda as limitaçõe e avanços terapêuticos no cenário do hepatocarcinoma metastático.
 Em artigo exclusivo, o oncologista Thiago William Carnier Jorge (foto), do Centro Paulista de Oncologia e do Centro de Oncologia do Hospital Oswaldo Cruz, em São Paulo, aborda as limitaçõe e avanços terapêuticos no cenário do hepatocarcinoma metastático.
Em artigo exclusivo, o oncologista Thiago William Carnier Jorge (foto), do Centro Paulista de Oncologia e do Centro de Oncologia do Hospital Oswaldo Cruz, em São Paulo, aborda as limitaçõe e avanços terapêuticos no cenário do hepatocarcinoma metastático.
Introdução
{jathumbnail off}Apesar de ser o quinto câncer mais comum do mundo e o segundo de maior mortalidade, o hepatocarcinoma persiste com prognóstico pobre na doença avançada e o tratamento sistêmico continua extremamente desanimador. Sem tratamento específico, um paciente com carcinoma hepatocelular localizado tem sobrevida média de 6 a 9 meses e, com a doença avançada, em torno de 1 a 2 meses (Montella, Addeo, & Prete, 2016). O paciente geralmente apresenta-se com cirrose subjacente, o que dificulta muito tratamento devido às condições de base. Metabolização hepática das drogas, interações medicamentosas com as demais substâncias de uso continuo e complicações próprias da cirrose, como sangramentos gastrointestinais, perda de líquido para o terceiro espaço e encefalopatia subjacente que piora a aderência ao tratamento, são exemplos que refletem a complexidade deste cenário.
Diante do exposto, está mais do que justificado screening e prevenção dos pacientes de risco. Tratamento de infecções virais pelos vírus C e B, medidas para evitar uso de álcool e obesidade, dosagem de alfafetoproteína e uso de exames de imagem como ferramentas de diagnóstico precoce são ainda a melhor arma contra o hepatocarcinoma. Quando factível, terapias como ressecções cirúrgicas, transplantes hepáticos, radioablação e,ultimamente, radioterapia estereotáxica, têm potencial curativo. Mas, e quando a doença já se encontrava avançada ou metastática?
Quimioterapia citotóxica
Até o fim da década de 2000, as únicas terapias disponíveis eram baseadas em quimioterapia citotóxica. Extremamente desapontadores e, na grande maioria das vezes obtidos de estudos pequenos de fase 2, dados de sobrevida indicavam que a média de um paciente com carcinoma hepatocelular metastático era em torno de 4 meses. Isso geralmente às custas de toxicidade importante e sem taxas de resposta animadoras.
Os agentes mais utilizados eram antracíclicos em esquema monodroga. Com taxas de resposta de até 20% e sobrevida média em torno de 4 meses, apresentavam ainda a limitação de cardiotoxicidade com doses cumulativas. E, mesmo estudos com combinações de drogas, mostravam taxas de respostas superiores, mas sem benefício clínico comprovado quanto ao aumento de sobrevida.
Um exemplo disso é o estudo que comparou uma poliquimioterapia baseada em platina, doxorrubicina, fluoracil e interferon (PIAF) comparada à doxorrubicina agente único. Neste trial, apesar de 20% de taxa de resposta para a poliquimioterapia comparada a 10% para o uso de doxorrubicina agente único, a sobrevida global foi semelhante entre os braços, atingindo em torno de 8 meses. Além disso, a toxicidade foi muito mais importante no esquema de múltiplos agentes, inclusive com 9% de mortalidade relacionada ao tratamento (Yeo et al., 2005).
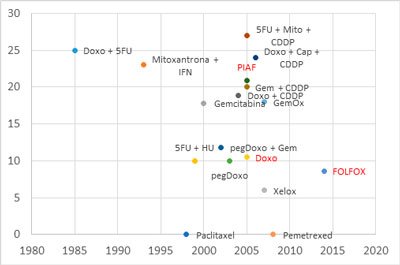
Figura 1. Taxa de resposta das diversas quimioterapias para hepatocarcinoma. Em vermelho, os estudos fase III
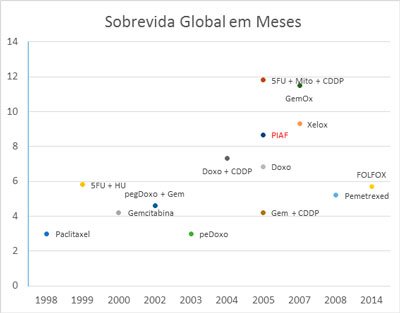
Figura 2. Sobrevida Global das diversas quimioterapias para hepatocarcinoma. Em vermelho, os estudos fase III
Drogas Alvo Moleculares
Em 2008, com a publicação no New England Journal of Medicine do estudo que mostrou eficácia de sorafenibe como primeira linha de tratamento para pacientes com hepatocarcinoma avançado, a quimioterapia foi deixada de lado nas localidades onde já se achava disponível a medicação. Tanto o estudo Sharp quanto o estudo Asian Pacific mostraram um ganho de sobrevida do emprego de sorafenib na dose de 800 miligramas/dia(Llovet et al., 2008)(Cheng et al., 2009). O primeiro estudo utilizava-se de população ocidental e o segundo de população oriental. No Sharp, o ganho de sobrevida foi maior (10.7 vs 7.9 meses) comparado ao Asian Pacific (6.5 vs 4.2 meses), provavelmente relacionado à diferença do fator etiológico causador de cirrose.
Críticas relacionadas aos estudos dão conta de uma população com cirrose muito inicial para randomização (Child A), o que, teoricamente, dificultaria seu uso em situação de vida real. Mesmo assim, a maioria dos médicos utilizam o tratamento como primeira linha em pacientes que apresentam cirrose Child B e análises pós marketing mostram que existe eficácia também nestes pacientes. Por outro lado, também mostram que essas populações tendem a apresentar maior toxicidade relacionada ao tratamento com consequentes reduções de doses que podem impactar negativamente em seu benefício de ganho de sobrevida(Daniele et al., 2015).
Infelizmente, não há nenhum estudo que compare sorafenibe isoladamente com quimioterapia em primeira linha de tratamento. Com isso, um ensaio fase III chinês que fazia o uso de FOLFOX comparado a doxorrubicina em primeira linha foi mantido mesmo com os dados de positividade do Sharp. Interessante é que este estudo não mostrou superioridade de FOLFOX frente a doxorrubicina isolada (SG 6,4 vs 4,97 meses com P=0.07), apesar de haver tendência para tal (Liccioni, Reig, & Bruix, 2014)(Qin et al., n.d.). Mesmo assim, por ser a quimioterapia relativamente fácil de ser administrada e com toxicidade manejável, desdobramentos na China quanto a custo efetividade da quimioterapia comparada ao uso de sorafenibe em primeira linha, já que 55% dos hepatocarcinomas do mundo se dão naquele país, ainda são discutidos (Zhang, Wen, & Li, 2016).
Ficou claro que, apesar do advento de sorafenibe, o tratamento continuava ainda muito frustro, sem nenhuma quimioterapia citotóxica efetiva e sem padrão de tratamento em segunda linha. Foram tentadas diversas combinações com sorafenibe em primeira linha, todas mostrando-se negativas, sejam elas quimioterapia, tratamentos locais como quimioembolização(Lencioni et al., 2016)ou novas drogas alvos moleculares (Zhu et al., n.d.). Além disso, moléculas com mecanismo de ação semelhante ao sorafenibe (inibidores de VEGF, principalmente) também mostraram-se negativas em primeira linha (Cainap et al., n.d.; Cheng et al., n.d.; Johnson et al., n.d.).
Já em segunda linha, todos os estudos vinham mostrando-se negativos, como everolimus, ramucirumabe e brivanibe (Llovet et al., n.d.; Zhu et al., 2014, 2015). Mas, felizmente, no Congresso Mundial de Câncer Gastrointestinal realizado em Barcelona este ano, o estudo RESORCE mostrou-se positivo com Regorafenib. Neste trial, pacientes receberam regorafenibe na dose de 160 miligramas uma vez por dia por 21 dias a cada 28 dias de ciclo, ou placebo. 65.2% dos pacientes mostraram benefício clínico com o uso da droga (resposta ou doença estável) contra 36.1% dos pacientes em uso de placebo. Além disso, a sobrevida mediana dos pacientes em uso de regorafenib foi de 10.6 meses contra 7.8 meses e a sobrevida livre de progressão foi de 3.1 meses contra 1.5 meses. O perfil de toxicidade foi muito semelhante ao do sorafenibe. (Bruix, J. WCGIC 2016).
| Agente | Fase | Resultado | Referência |
| Brivanib | Fase III vs. Placebo | 9.4 vs 8.2 meses OS | Llovet JCO 2013 |
| Everolimus | Fase III vs. Placebo | 7.6 vs 7.3 meses OS | Zhu JAMA 2014 |
| Ramucirumab | Fase III vs. Placebo | 9.2 vs 7.6 meses OS | Zhu Annals of Oncology 2014 |
| Cabozantinib | Fase III vs. Placebo | Recrutando | |
| Tivantinib | Fase III vs. Placebo | Recrutando | |
| Regorafenib | Fase III vs. Placebo | 10.6 vs 7.8 meses OS | Bruix World GI 2016 |
| Doxorrubicina | Fase III vs. Placebo | 10.1 meses OS retro | Abou-Alfa JCO 2012 |
Tabela 1. Sobrevida Global das terapias em segunda linha para hepatocarcinoma.
Conclusão
Em suma, pacientes com diagnóstico de hepatocarcinoma avançado ou metastático provavelmente receberão sorafenibe como primeira linha e regorafenib como segunda linha. O uso de quimioterapia será provavelmente restrito a pacientes que não têm acesso às drogas inibidoras de tirosina quinase ou que já fizeram uso de ambas e continuam com performance status bom para tratamento.
Autor: Thiago William Carnier Jorge
Oncologista Clínico do Centro Paulista de Oncologia e do Centro de Oncologia do Hospital Oswaldo Cruz, em São Paulo, e membro da Diretoria Médica do Grupo Oncoclínicas do Brasil
Referências:
Cainap, C., Qin, S., Huang, W.-T., Joo Chung, I., Pan, H., Cheng, Y., … Oncologist, S. (n.d.). Linifanib Versus Sorafenib in Patients With Advanced Hepatocellular Carcinoma: Results of a Randomized Phase III Trial. J Clin Oncol, 33, 172–179. http://doi.org/10.1200/JCO.2013.54.3298
Cheng, A.-L., Kang, Y.-K., Chen, Z., Tsao, C.-J., Qin, S., Kim, J. S., … Guan, Z. (2009). Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. The Lancet Oncology, 10(1), 25–34. http://doi.org/10.1016/S1470-2045(08)70285-7
Cheng, A.-L., Kang, Y.-K., Lin, D.-Y., Park, J.-W., Kudo, M., Qin, S., … di Ricovero Cura Carattere Scientifico Fondazione Maugeri, I. (n.d.). Sunitinib Versus Sorafenib in Advanced Hepatocellular Cancer: Results of a Randomized Phase III Trial. J Clin Oncol, 31, 4067–4075. http://doi.org/10.1200/JCO.2012.45.8372
Daniele, B., Croitoru, A., Papandreou, C., Bronowicki, J.-P., Mathurin, P., Serejo, F., … Bodoky, G. (2015). Impact of sorafenib dosing on outcome from the European patient subset of the GIDEON study. Future Oncol, 11(18), 2553–2562. http://doi.org/10.2217/fon.15.163
Johnson, P. J., Qin, S., Park, J.-W., Poon, R. T. P., Raoul, J.-L., Philip, P. A., … John-Son, P. J. (n.d.). Brivanib Versus Sorafenib As First-Line Therapy in Patients With Unresectable, Advanced Hepatocellular Carcinoma: Results From the Randomized Phase III BRISK-FL Study. J Clin Oncol, 31, 3517–3524. http://doi.org/10.1200/JCO.2012.48.4410
Lencioni, R., Llovet, J. M., Han, G., Tak, W. Y., Yang, J., Guglielmi, A., … Bruix, J. (2016). Sorafenib or placebo plus TACE with doxorubicin-eluting beads for intermediate stage HCC: The SPACE trial. Journal of Hepatology, 64(5), 1090–8. http://doi.org/10.1016/j.jhep.2016.01.012
Liccioni, A., Reig, M., & Bruix, J. (2014). FOLFOX-4 vs. doxorubicin for hepatocellular carcinoma: Could a negative result be accepted as positive? Journal of Hepatology, 61, 164–165. http://doi.org/10.1016/j.jhep.2014.03.024
Llovet, J. M., Decaens, T., Raoul, J.-L., Boucher, E., Kudo, M., Chang, C., … Park, J.-W. (n.d.). Brivanib in Patients With Advanced Hepatocellular Carcinoma Who Were Intolerant to Sorafenib or for Whom Sorafenib Failed: Results From the Randomized Phase III BRISK-PS Study. J Clin Oncol, 31, 3509–3516. http://doi.org/10.1200/JCO.2012.47.3009
Llovet, J. M., Ricci, S., Mazzaferro, V., Hilgard, P., Gane, E., Blanc, J.-F., … Bruix, J. (2008). Sorafenib in Advanced Hepatocellular Carcinoma. N Engl J Med, 359, 378–90.
Montella, L., Addeo, R., & Prete, S. Del. (2016). Hepatocellular carcinoma: Will novel targeted drugs really impact the next future? World J Gastroenterol. http://doi.org/10.3748/wjg.v22.i27.6114
Qin, S., Bai, Y., Lim, H. Y., Thongprasert, S., Chao, Y., Fan, J., … Hospi-Tal, M. (n.d.). Randomized, Multicenter, Open-Label Study of Oxaliplatin Plus Fluorouracil/Leucovorin Versus Doxorubicin As Palliative Chemotherapy in Patients With Advanced Hepatocellular Carcinoma From Asia. J Clin Oncol, 31, 3501–3508. http://doi.org/10.1200/JCO.2012.44.5643
Yeo, W., Mok, T. S., Zee, B., Leung, T. W. T., Lai, P. B. S., Lau, W. Y., … Johnson, P. J. (2005). ARTICLE ARTICLES A Randomized Phase III Study of Doxorubicin Versus Cisplatin/Interferon α-2b/Doxorubicin/Fluorouracil (PIAF) Combination Chemotherapy for Unresectable Hepatocellular Carcinoma. Journal of the National Cancer Institute, 97(20). http://doi.org/10.1093/jnci/dji315
Zhang, P., Wen, F., & Li, Q. (2016). FOLFOX4 or sorafenib as the first-line treatments for advanced hepatocellular carcinoma: A cost-effectiveness analysis. Digestive and Liver Disease : Official Journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver. http://doi.org/10.1016/j.dld.2016.07.007
Zhu, A. X., Kudo, M., Assenat, E., Cattan, S., Kang, Y.-K., Lim, H. Y., … JM, L. (2014). Effect of Everolimus on Survival in Advanced Hepatocellular Carcinoma After Failure of Sorafenib. JAMA, 312(1), 57. http://doi.org/10.1001/jama.2014.7189
Zhu, A. X., Park, J. O., Ryoo, B.-Y., Yen, C.-J., Poon, R., Pastorelli, D., … Kudo, M. (2015). Ramucirumab versus placebo as second-line treatment in patients with advanced hepatocellular carcinoma following first-line therapy with sorafenib (REACH): a randomised, double-blind, multicentre, phase 3 trial. The Lancet Oncology, 16(7), 859–870. http://doi.org/10.1016/S1470-2045(15)00050-9
Zhu, A. X., Rosmorduc, O., Jeffry Evans, T., Ross, P. J., Santoro, A., Jose Carrilho, F., … Kang, Y.-K. (n.d.). SEARCH: A Phase III, Randomized, Double-Blind, Placebo-Controlled Trial of Sorafenib Plus Erlotinib in Patients With Advanced Hepatocellular Carcinoma. J Clin Oncol, 33, 559–566. http://doi.org/10.1200/JCO.2013.53.7746
LBA-03: Efficacy and safety of regorafenib versus placebo in patients with hepatocellular carcinoma (HCC) progressing on sorafenib: Results of the international, randomized phase 3 RESORCE trial will be presented by Jordi Bruix during Session VIII: Liver Malignancies on Thursday, 30 June 2016, 17:40 (CEST).








